
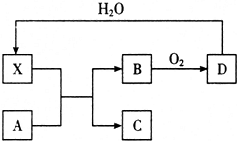
 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )| A. | X能使蔗糖变黑主要体现了 X的强氧化性 | |
| B. | 若A为铁,则足量A与X在室温下即可完全反应 | |
| C. | 若A为碳单质,则将C通入少量澄清石灰水中,最终一定有白色沉淀产生 | |
| D. | 工业上,B转化为D的反应需使用催化剂 |
分析 X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,D和水反应生成硫酸,则D是三氧化硫,B和氧气反应生成三氧化硫,则B是二氧化硫.
解答 解:X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,D和水反应生成硫酸,则D是三氧化硫,B和氧气反应生成三氧化硫,则B是二氧化硫,
A.X使蔗糖变黑的现象主要体现了X的脱水性,故A错误;
B.若A是铁,常温下,铁与浓硫酸发生钝化现象,所以铁不能完全溶解,故B错误;
C.若A是碳,浓硫酸和碳反应生成二氧化碳、二氧化硫和水,二氧化碳和少量氢氧化钙反应生成可溶性的碳酸氢钙,故C错误;
D.工业上,二氧化硫转化为三氧化硫的反应条件为高温、常压、使用催化剂,故D正确;
故选D.
点评 本题考查物质的性质,正确推断物质是解本题关键,本题的“题眼”是“x能使蔗糖粉末变黑”,以此来进行分析判断,难度中等.


科目:高中化学 来源: 题型:解答题
 根据图填空:
根据图填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 小苏打溶液中加入少量石灰水:HCO$\overline{3}$+Ca2++OH-═CaCO3↓+H2O | |
| D. | 用SO2还原含Cr2O72-的酸性废水:Cr2O72-+3SO2+2H+═2Cr3++3SO42-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯锌和稀硫酸反应 | B. | 用含铜等的粗锌和稀硫酸反应 | ||
| C. | 用纯锌和浓硫酸反应 | D. | 用含铜等的粗锌和稀硝酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com