
| A. | HCl的水溶液呈强酸性,HF的水溶液也呈强酸性 | |
| B. | CH4是正四面体结构,SiH4也是正四面体结构 | |
| C. | Cl2与Fe反应生成FeCl3,S与Fe反应生成Fe2S3 | |
| D. | CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
分析 A.HCl的水溶液呈强酸性,HF不一定是强酸;
B.甲烷是正四面体结构,C和Si均为碳族元素;
C.Cl2与Fe反应生成FeCl3,S的氧化性不如Cl2强;
D.CaCO3与稀硝酸反应生成CO2,硝酸具有氧化性.
解答 解:A.HCl的水溶液呈强酸性,HF是弱酸,不完全电离,当达到一定浓度时,HF可以是强酸,因此HF的水溶液不一定是强酸性,故A错误;
B.甲烷是正四面体结构,C和Si均为碳族元素,因此硅烷SiH4也为正四面体结构,故B正确;
C.Cl2与Fe反应生成FeCl3,S的氧化性不如Cl2强,则S与Fe反应生成FeS,故C错误;
D.CaCO3与稀硝酸反应生成CO2,硝酸具有氧化性,CaSO3与稀硝酸反应,硝酸会氧化S生成最高价态,产物是CaSO4,不产生SO2,故D错误.
故选B.
点评 本题考查物质性质的类比,结构的类比,注意化学知识的迁移,掌握基本的一些反应和知识是解题的关键,题目难度不大.值得一提的是,HF在稀溶液时是弱酸,当浓度达到5mol/L时,就是相当强的酸了.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | 6MgO+4Al$\frac{\underline{\;\;△\;\;}}{\;}$6Mg+2Al2O3 | D. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸是强酸:H2SO4=2H++SO42- | |
| B. | CO2使澄清石灰水变浑浊:CO2+2OH-=CO32-+H2O | |
| C. | SO2通入水中溶液显酸性:SO2+H2O?H2SO3 | |
| D. | H2具有还原性:CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 杂质 | 加入试剂的化学式 |
| 硫酸盐 | BaCl2 |
| MgCl2 | NaOH |
| CaCl2 | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HSO3-的水解离子方程式:HSO3-+H2O?H3O++SO32- | |
| B. | 以银为电极电解硫酸铜溶液离子方程式:2Cu2++2H2O $\frac{\underline{\;通电\;}}{\;}$ 2Cu+4H++O2↑ | |
| C. | 向FeI2溶液中通入一定量Cl2的离子方程式可能为:2Fe2++2Cl2+2I-═2Fe3++4Cl-+I2 | |
| D. | 乙烯的燃烧热是akJ/mol,表示乙烯燃烧热的热化学方程式为:C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-akJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
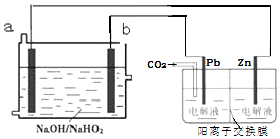
| A. | a为电源的负极 | |
| B. | 阴极的电极反应式为2CO2+2e-═C2O42- | |
| C. | 电解过程中电子的流向为b→Pb→Zn→a | |
| D. | a电极每消耗1mol HO2-,同时可制得0.5molZnC2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色沉淀转化为红褐色沉淀的离子方程式是:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 | |
| B. | 上述实验说明:Mg(OH)2的KSP大于Fe(OH)3的KSP | |
| C. | 最后所得溶液中:c (Cl-)=c (NH4+)+2c (Mg2+)+3c (Fe3+) | |
| D. | 最后所得溶液中:c (Cl-)>c (NH4+)>c (Mg2+)>c (Fe3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有1 mol NH3分子 | |
| B. | 含1 mol NH3•H2O | |
| C. | 含有NH3和NH4+的物质的量之和为1 mol | |
| D. | 含NH3、NH3•H2O、NH4+的物质的量之和为1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com