
| 1 |
| 2 |
 ,故答案为:
,故答案为: ;
;
| ||
| △ |
| ||
| △ |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、烧碱溶液与碳酸氢钠溶液:HCO3-+OH-=H2O+CO2↑ |
| B、氧化钠与盐酸:O2-+2H+=H2O |
| C、碳酸氢钠与稀硫酸:CO32-+2H+=H2O+CO2↑ |
| D、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
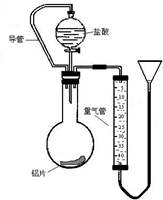 (1)在探究铝和盐酸反应的实验现象是:“向铝片滴加盐酸,开始铝片表面出现少量气泡,而且气泡越来越多,甚至于使酸液‘沸腾’起来.”请解释上述现象.
(1)在探究铝和盐酸反应的实验现象是:“向铝片滴加盐酸,开始铝片表面出现少量气泡,而且气泡越来越多,甚至于使酸液‘沸腾’起来.”请解释上述现象.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸点:X2Y>X2W |
| B、由X、Y、Z、W四种元素组成的化合物既含有共价键又含离子键 |
| C、原子半径:X<Y<Z<W<R |
| D、Y与W形成的化合物WY2是形成酸雨的主要物质之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 共价键 | C=O | H-H | C-O | C-H | O-H |
| 键能KJ?mol-1 | 750 | 436 | 358 | 413 | 463 |

查看答案和解析>>
科目:高中化学 来源: 题型:
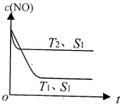 (1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.
(1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com