
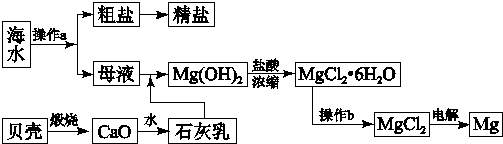
分析 海水通过蒸发结晶晒盐得到粗盐和母液,海水中镁元素以Mg2+形式存在,贝壳的主要成分为碳酸钙,碳酸钙加热分解得到氧化钙,氧化钙与水反应生成石灰乳;
石灰乳和镁离子反应生成氢氧化镁沉淀,氢氧化镁和盐酸反应生成氯化镁和水,无水氯化镁在熔融状态下,通过电解得到金属镁,据此回答.
(1)海水通过蒸发结晶晒盐得到粗盐和母液;
(2)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(3)用作镁蒸气的冷却剂,应不与Mg反应,镁和二氧化碳反应生成氧化镁和碳,以此来解答;
(4)根据题中涉及的反应类型进行分析;
(5)根据氯气能氧化溴离子得到氯离子和单质溴书写.
解答 解:(1)将水与盐分离,可用蒸馏,海水通过蒸发结晶晒盐得到粗盐和母液,
故答案为:蒸发结晶;
(2)SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,最后加入盐酸,试剂添加的顺序可以为③①②,
故答案为:③①②;
(3)镁条与二氧化碳发生置换反应,生成碳与氧化镁,反应为:2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(4)整个过程中发生的反应有:化合反应:CaO+H2O=Ca(OH)2,复分解反应:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 ,Mg(OH)2+2HCl=MgCl2+2H2O 分解反应有:MgCl2$\frac{\underline{\;电解\;}}{\;}$Cl2↑+Mg,没有涉及到的反应类型是置换反应,
故答案为:C;
(5)氯气氧化溴离子生成溴单质,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,
故答案为:2Br-+Cl2=Br2+2Cl-.
点评 本题考查海水资源综合应用,为高频考点,涉及流程分析及混合物分离提纯等,把握发生的反应及物质性质为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| 实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | |
| Ⅱ | 607 | 0.22 | 0.82 | ||
| Ⅲ | 620 | 0.1 | 0.4 | 6.74×10-3 | |
| A. | 该反应正反应为吸热反应 | |
| B. | 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行 | |
| C. | 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol | |
| D. | 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
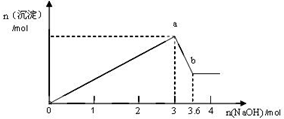 现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )
现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )| A. | 0.4 mol/L | B. | 1.8 mol/L | C. | 1.6 mol/L | D. | 1.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:100:1011 | B. | 1:12:11 | C. | 14:12:11 | D. | 14:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酚酞试液 | B. | 用石蕊溶液 | ||
| C. | NaOH溶液 | D. | 用硝酸酸化后的Ba(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于10.00mL | B. | 小于10.00mL | C. | 等于10.00mL | D. | 等于11.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为Al不活泼,所以可以用铝合金制作窗户 | |
| B. | 氯气泄漏后应顺风向低处跑 | |
| C. | SO2和HClO都具有漂白性,两者的漂白原理相同 | |
| D. | 我国城市环境中的大气污染物主要有SO2、NO2、CO、可吸入颗粒物等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com