
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示.
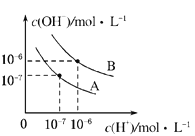
(1)95℃时水的电离平衡曲线应为______(填“A”或“B”),理由是______.
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH______7.
(3)在曲线B所对应的温度下,将0.02molL﹣1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=______.
【答案】B水电离需要吸热,温度越高KW越大等于>或=10
【解析】试题分析:本题考查水的电离、溶液的酸碱性等,题目难度中等。利用水电离的影响因素、pH计算相关知识进行作答。
(1)曲线A条件下Kw=c(H+)c(OH-)=10-7×10-7=10-14,曲线B条件下c(H+)=c(OH-)=10-6mol/L,Kw=c(H+)c(OH-)=10-12;水的电离时吸热过程,加热促进电离,Kw增大,95℃时水的电离平衡曲线应为B。
(2)酸溶液中分析水的电离,计算溶液中氢氧根浓度;碱溶液中分析水的电离,计算溶液中氢离子浓度。曲线A所对应的温度下,pH=2的HCl溶液中氢氧根浓度为10-12mol/L;pH=12的某BOH溶液中氢离子浓度为10-12mol/L。若水的电离程度分别用α1、α2表示,则α1等于α2;若将二者等体积混合,若BOH为强碱,二者恰好完全反应,生成的NaB为强酸强碱盐,溶液呈中性,则混合溶液的pH=7;若BOH为弱碱,则碱远过量,溶液呈碱性,pH>7。
(3)95℃时,0.02molL﹣1的Ba(OH)2溶液中氢氧根浓度为0.04mol/L,0.02molL﹣1的NaHSO4溶液溶液中氢离子浓度为0.02molL﹣1,二者等体积混合,混合液中氢氧根浓度为(0.04-0.02)molL﹣1÷2=0.01 molL﹣1,95℃时,Kw= 10-12,溶液中氢离子浓度为10-10 molL﹣1,所得混合液的pH=-lgc(H+)=10。


科目:高中化学 来源: 题型:
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究②④
①实验Ⅰ中生成红色物质的离子方程式为:____________________________
经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:_____________________
③请写出60s后反应进一步加快可能的原因(写出两条)_____________________________
(2)对实验Ⅱ进行研究
实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用。
假设二:________________________
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
_____________________________________
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________________
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:______________________________________
(4)请设计实验证明Cl-对Al与H+的反应同样起到相似的作用:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用下图所示部分装置进行实验(夹持装置略)
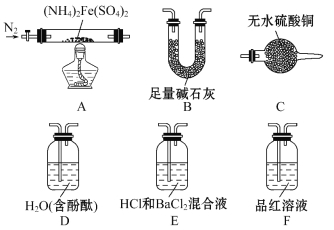
实验Ⅰ 验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
(1)所选用装置的正确连接顺序为_______(填装置的字母序号)。
(2)证明有水蒸气生成的实验现象为___________________________________。
(3)证明有氨气生成的实验现象为_____________________________________。
(4)A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4:_______________________。
实验Ⅱ 乙同学为探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验。
(5)实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是_________________________________。
(6)B的作用是_____________________________________。
(7)实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
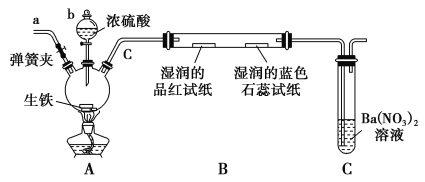
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为________;实验过程中,装置B中观察的现象是______________________。
(2)装置C中有白色沉淀生成,该反应化学方程式为_______________________。
(3)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:_______________________。
(4)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是___________________________。
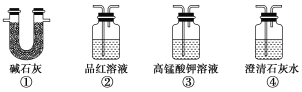
(5)某同学通过验证实验后期装置A中产生的气体中还含有H2,反应的离子方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法不正确的是
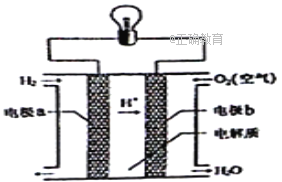
A. 该装置将化学能转化为电能
B. 为了增加灯泡亮度,可以将电极碳棒变得粗糙多孔
C. 电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a
D. 该电池的总反应:2H2+O2=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有V、W、X、Y、Z五种元素,它们的原子序数依次增大,且都小于20;其中X和Z是金属元素。已知V和Z属同一族,它们原子最外电子层上只有1个电子,W和Y也属同一族,W原子最外电子层上电子数是次外电子层上电子数的3倍,X原子最外电子层上电子数等于Y原子最外电子层上电子数的一半。请用相关的元素符号回答:
(1)X、Z各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为_____________;
(2)X最高价氧化物对应的水化物在水中电离方程式为:____________________________________;
(3)W与Z 可形成化合物Z2W2,该化合物的电子式为 ______________________________________;
(4)Y与Z形成的化合物水溶液pH ______ 7(填“>”、“<”或“=”),用离子方程式表示其原因 ____________________________________________________________;
(5)标准状况下,Y的最高价氧化物为无色晶体,该条件下0.20 mol该物质与一定量液态水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式:________________________________;
(6)W与V 可形成化合物V2W2,该化合物的结构式为 ______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com