


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
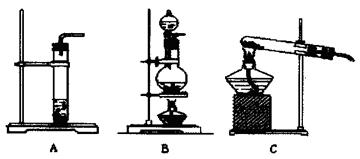
| 实验步骤 | 写出相应的离子方程式 |
| ①取试样加入足量10%的NaOH溶液,充分振荡后再将反应混合物倒入蒸馏烧瓶中蒸馏得到乙醇、水的混合物和产品A | ①OH-+C6H5-OH→C6H5O-+H2O ② |
| ②向步骤①的馏分中加入足量的生石灰,再次蒸馏浓缩,蒸气冷凝后得乙醇。 | CaO+H2O=Ca(OH)2 |
| ③向产品A中通入足量CO2,静置后分液得 和溶液B。 | |
| ④再向溶液B中加入足量 、静置、过滤后可得苯甲酸。 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 实验方案 | 现象、结论 |
| A | 加入盐酸 | 产生无色气体,含铝、铁、镁三种元素 |
| B | 加入NaOH 溶液 | 有无色气体产生,含有铝元素 |
| C | 加入盐酸后,所得溶液中再加入少量NaOH溶液 | 产生白色沉淀,含有镁元素 |
| D | 加入KSCN 溶液 | 溶液呈血红色,含有铁元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
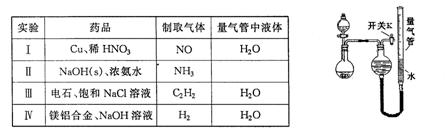
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10 .0mL .0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色,有少量气泡产生 |
| ② | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
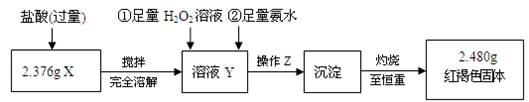



 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
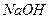 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度: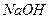 溶液所需的玻璃仪器为 。
溶液所需的玻璃仪器为 。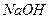 溶液滴定到终点。
溶液滴定到终点。| 实验编号 | 盐酸的体积(mL) | 标准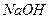 溶液的体积(mL) 溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
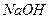 溶液前未润洗
溶液前未润洗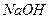 溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡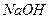 溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
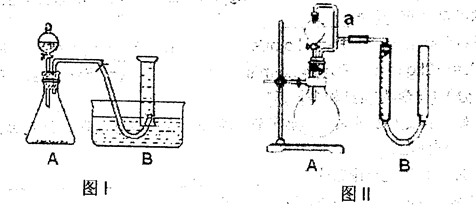
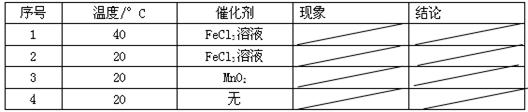
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
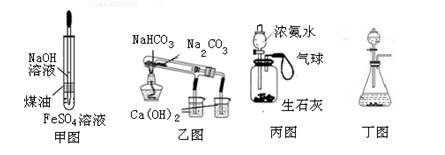
| A.用甲图装置制备少量的氢氧化亚铁 |
| B.用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
| C.用丙图装置可以实现使气球膨胀 |
| D.用丁图装置可以用于实验室制取氧气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学家提出的假设不一定能被实验证实 |
| B.同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
| C.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律 |
| D.科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,标志着化学已成为以理论研究为主的学科,不需要再做化学实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com