
| A. | 该溶液中一定含硫酸根离子 | |
| B. | 该溶液中一定含有银离子 | |
| C. | 该溶液中一定含有硫酸根离子和银离子 | |
| D. | 该溶液中可能含有硫酸根离子或银离子 |
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:2Al3++2NH4++4SO42-+4Ba2++10OH-═2AlO2-+4BaSO4↓+2NH3•H2O+4H2O | |
| B. | 碳酸氢镁溶液中加过量澄清石灰水:Mg2++2OH-+2HCO3-+Ca2+═MgCO3↓+2H2O+CaCO3↓ | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO32-+H3O+?HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用已脱硫的煤作燃料 | |
| B. | 开发氢能等能源代替化石燃料,有利于保护环境 | |
| C. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| D. | 用“绿色化学”工艺,使原料尽可能转化为所需要的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往紫色石蕊试液中通入氨气,溶液变蓝 | |
| B. | 饱和FeCl3溶液在沸水中变成红褐色胶体 | |
| C. | 向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 | |
| D. | SO2使滴有酚酞的NaOH溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 搅拌能加快蔗糖在水中的溶解,其原因是增大了蔗糖的溶解度 | |
| B. | 天气闷热时,鱼塘的鱼会接近水面游动,原因是温度高压强小,氧气的溶解度小 | |
| C. | 夏天,铜制眼镜架表面出现的绿色物质[主要成分 Cu2(OH)2CO3],可用稀盐酸除去 | |
| D. | 敞口放置的酒精没有燃烧的原因是温度没有达到酒精的着火点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.
合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

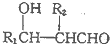 (R1、R2为烃基或H)
(R1、R2为烃基或H)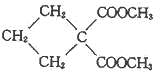 +HBr+HCl
+HBr+HCl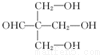 .
. .
.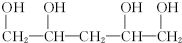 .
.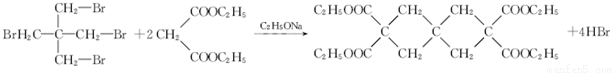 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
| 步骤 | 实验操作 | 预测现象和结论 |
| ① | 往不再产生氯气的装置中,加入NaCl固体,继续加热 | 若有黄绿色气体生成,则假设1成立 |
| ② | 往不再产生氯气的装置中,加入浓硫酸并继续加热 | 若有黄绿色气体生成,则假设2成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com