
| A. | CO是氧化剂 | B. | CO是还原剂 | ||
| C. | CO既是氧化剂又是还原剂 | D. | CO既不是氧化剂又不是还原剂 |
科目:高中化学 来源: 题型:解答题

压强 温度℃ | 0.2Mpa | 1.0Mp | 10Mpa |
| 400 | 97.2% | 99.5% | 99.7% |
| 500 | 91.5% | 96.9% | 97.8% |
| 600 | 72.6% | 85.8% | 89.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | 将少量溴水加入KI溶液中,充分反应后再加入CCl4,振荡,静置,下层液体呈紫色 | 氧化性:Br2>I2 |
| B | 常温下,打磨后的铝片放入HNO3中,无明显现象 | 常温下,铝不与浓HNO3反应 |
| C | 向一定量AgNO3溶液中,先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 用pH计测定NaF溶液和CH3COONa溶液可知:pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )有还原性,易被氧化;
)有还原性,易被氧化;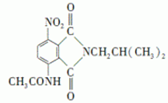 .
.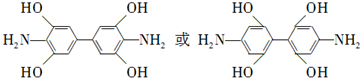 .
.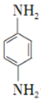 是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
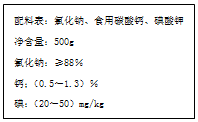 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
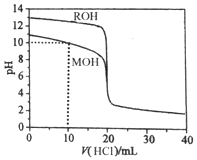
| A. | pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-) | |
| C. | 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-) | |
| D. | V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 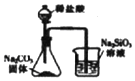 如图用于证明非金属性强弱:Cl>C>S | |
| B. |  如图用于分离I2和NH4Cl | |
| C. |  如图用于测定某NaOH溶液的浓度 | |
| D. | 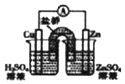 如装置能组成Cu-Zn原电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com