
分析 经过5分钟后,测得D的浓度为0.5mol/L,生成D的物质的量为0.5mol/L×2=1mol,v(D)=$\frac{0.5mol/L-0}{5min}$=0.1mol/(L•min),C的平均反应速率是0.1mol/(L•min),由速率之比等于化学计量数之比可知,
x=2,设开始时A、B的物质的量均为n,则
3A(g)+B(g)═2C(g)+2D(g)
开始 n n 0 0
转化 1.5 0.5 1 1
5min n-1.5 n-0.5 1 1
c(A):c(B)=3:5,
则$\frac{n-1.5}{n-0.5}$=$\frac{3}{5}$,解得n=3mol,以此来解答.
解答 解:经过5分钟后,测得D的浓度为0.5mol/L,生成D的物质的量为0.5mol/L×2=1mol,v(D)=$\frac{0.5mol/L-0}{5min}$=0.1mol/(L•min),C的平均反应速率是0.1mol/(L•min),由速率之比等于化学计量数之比可知,
x=2,设开始时A、B的物质的量均为n,则
3A(g)+B(g)═2C(g)+2D(g)
开始 n n 0 0
转化 1.5 0.5 1 1
5min n-1.5 n-0.5 1 1
c(A):c(B)=3:5,
则$\frac{n-1.5}{n-0.5}$=$\frac{3}{5}$,解得n=3mol,
(1)此时A的浓度为$\frac{3mol-1.5mol}{2L}$=0.75mol/L,故答案为:0.75;
(2)由上述计算可知,开始时A、B的物质的量均为3mol,故答案为:3;
(3)B的平均反应速率为$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L•min),故答案为:0.05;
(4)由上述分析可知,x=2,故答案为:2;
(5)5分时A的转化率为$\frac{1.5mol}{3mol}$×100%=50%,故答案为:50.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、各物质的量的关系等为解答的关键,侧重分析与计算能力的考查,注意速率之比等于化学计量数之比确定x,题目难度不大.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Zn | Ag | C | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的CO2通入Na2SiO3溶液中 | |
| B. | 向AlCl3溶液中滴加稀氨水至过量 | |
| C. | 少量的CO2通入BaCl2溶液中 | |
| D. | 向FeCl3溶液中滴加NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
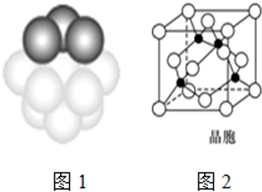
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
序号 | 时间/min 物质的量/mol 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

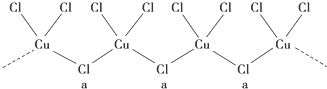
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为p轨道是“8”字形的,所以p的电子走“8”字形 | |
| B. | K能级有3s,3p,3d,3f四个轨道 | |
| C. | 碳原子的2p轨道上有两个自旋相反的电子 | |
| D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com