
ΓΨΧβΡΩΓΩΡ≥Μ·―ß―–ΨΩ–‘―ßœΑ–ΓΉιάϊ”Ο“‘œ¬ΉΑ÷Ο÷Τ»Γ≤ΔΧΫΨΩΑ±ΤχΒΡ–‘÷ ΓΘ‘ΎAΉΑ÷Ο÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ2NH4Cl+Ca(OH)2![]() CaCl2+2NH3Γϋ+2H2OΓΘ
CaCl2+2NH3Γϋ+2H2OΓΘ
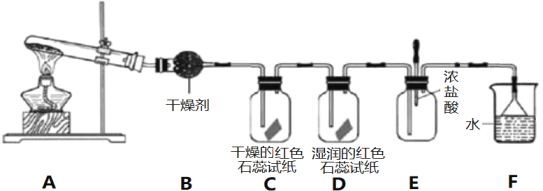
(1)BΉΑ÷Ο÷–ΒΡΗ…‘οΦΝ «_________________(ΧνΓΑΦν ·Μ“Γ±ΜρΓΑ≈®ΝρΥαΓ±)ΓΘ
(2)CΓΔDΉΑ÷Ο÷– ‘÷Ϋ―’…ΪΜαΖΔ…ζ±δΜ·ΒΡ «___________(ΧνΓ±CΓ±ΜρΓΑDΓ±)ΓΘ
(3)Β± Β―ιΫχ––“ΜΕΈ ±ΦδΚσΘ§ΦΖ―ΙEΉΑ÷Ο÷–ΒΡΫΚΆΖΒΈΙήΘ§ΒΈ»κ1-2ΒΈ≈®―ΈΥαΘ§Ω…Ιέ≤λΒΫEΉΑ÷Ο÷–ΒΡœ÷œσ «≤ζ…ζ_____________(ΧνΓ±ΑΉ―ΧΓ±ΜρΓΑΑΉΈμΓ±)ΓΘ
(4)…’±≠F÷–Υ°ΒΡΉς”Ο «________________________ΓΘ
(5)”ϊ÷ΤΒΟ±ξΉΦΉ¥Ωωœ¬11.2 LNH3Θ§÷Ν…Ό–η“ΣCa(OH)2ΒΡ÷ ΝΩΈΣ____________gΓΘ
ΓΨ¥πΑΗΓΩΦν ·Μ“ D ΑΉ―Χ Έϋ ’Εύ”ύΒΡNH3Θ§Ζά÷ΙΈέ»ΨΩ’Τχ(ΤδΥϋΚœάμ¥πΑΗΨυΗχΖ÷) 18.5g
ΓΨΫβΈωΓΩ
±Ψ Β―ιΈΣ÷Τ»Γ≤ΔΧΫΨΩΑ±ΤχΒΡ–‘÷ Θ§Τδ÷–AΉΑ÷ΟΈΣNH4ClΚΆCa(OH)2ΜλΚœΦ”»»÷Τ»ΓΑ±ΤχΒΡΉΑ÷ΟΘ§BΈΣΗ…‘οΑ±ΤχΒΡΉΑ÷ΟΘ§CΈΣΦλ―ιNH3 «ΖώΡή ΙΗ…‘οΒΡΚλ…Ϊ ·»ο ‘÷Ϋ±δάΕΒΡΉΑ÷ΟΘ§DΈΣΦλ―ιNH3 «ΖώΡή Ι Σ»σΒΡΚλ…Ϊ ·»ο ‘÷Ϋ±δάΕΒΡΉΑ÷ΟΘ§EΈΣ―ι÷ΛNH3ΚΆ≈®―ΈΥαΒΡΖ¥”ΠΉΑ÷ΟΘ§FΈΣΈ≤ΤχΈϋ ’ΉΑ÷ΟΘ§Ψί¥ΥΫαΚœΧβΗ…Ζ÷ΈωΫβ¥πΓΘ
(1)”……œ ωΖ÷ΈωΩ…÷ΣΘ§BΈΣΗ…‘οΑ±ΤχΒΡΉΑ÷ΟΘ§”…”ΎΑ±Τχ «Φν–‘ΤχΧεΘ§“ΜΑψ―Γ”ΟΦν ·Μ“Ϋχ––Η…‘οNH3Θ§Ι ¥πΑΗΈΣΘΚΦν ·Μ“ΘΜ
(2)NH3”κΥ°Ζ¥”ΠΩ……ζ≥…NH3ΓΛH2OΘ§œ‘Φν–‘Θ§Ω… ΙΚλ…Ϊ ·»ο±δάΕΘ§Υυ“‘NH3≤ΜΡή ΙΗ…‘οΒΡΚλ…Ϊ ·»ο ‘÷Ϋ±δάΕΘ§ΒΪΡή Ι Σ»σΒΡΚλ…Ϊ ·»ο ‘÷Ϋ±δάΕΘ§Ι ¥πΑΗΈΣΘΚDΘΜ
(3)≈®―ΈΥαΡή”κNH3Ζ¥”Π…ζ≥…NH4ClΙΧΧεΘ§Ζ¥”ΠΖΫ≥Χ ΫΈΣΘΚNH3+HCl===NH4ClΘ§œ÷œσΈΣ≤ζ…ζΑΉ―ΧΘ§Ι ¥πΑΗΈΣΘΚΑΉ―ΧΘΜ
(4)FΈΣΈ≤ΤχΈϋ ’ΉΑ÷ΟΘ§NH3ΦΪ“Ή»ή”ΎΥ°Θ§Ω…”ΟH2OΈϋ ’Εύ”ύΒΡNH3Θ§Ζά÷ΙΈέ»ΨΩ’ΤχΘ§Ι ¥πΑΗΈΣΘΚΈϋ ’Εύ”ύΒΡNH3Θ§Ζά÷ΙΈέ»ΨΩ’Τχ(ΤδΥϋΚœάμ¥πΑΗΨυΗχΖ÷)ΘΜ
(5)±ξΉΦΉ¥Ωωœ¬11.2LNH3ΒΡΈο÷ ΒΡΝΩΈΣ0.5molΘ§”…Ζ¥”ΠΖΫ≥Χ Ϋ2NH4Cl+Ca(OH)2![]() CaCl2+2NH3Γϋ+2H2OΩ…÷ΣΘ§ΟΩ…ζ≥…1molNH3–ηœϊΚΡ0.5molCa(OH)2Θ§‘ρ÷Τ»Γ±ξΉΦΉ¥Ωωœ¬0.5molNH3Θ§÷Ν…Ό–η“ΣCa(OH)2ΒΡΈο÷ ΒΡΝΩΈΣ0.25molΘ§÷ ΝΩΈΣ0.25molΓΝ74g/mol=18.5gΘ§Ι ¥πΑΗΈΣΘΚ18.5ΓΘ
CaCl2+2NH3Γϋ+2H2OΩ…÷ΣΘ§ΟΩ…ζ≥…1molNH3–ηœϊΚΡ0.5molCa(OH)2Θ§‘ρ÷Τ»Γ±ξΉΦΉ¥Ωωœ¬0.5molNH3Θ§÷Ν…Ό–η“ΣCa(OH)2ΒΡΈο÷ ΒΡΝΩΈΣ0.25molΘ§÷ ΝΩΈΣ0.25molΓΝ74g/mol=18.5gΘ§Ι ¥πΑΗΈΣΘΚ18.5ΓΘ


 ±Η’Ϋ÷–ΩΦΚ°ΦΌœΒΝ–¥πΑΗ
±Η’Ϋ÷–ΩΦΚ°ΦΌœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΦΉ¥Φ «“Μ÷÷–¬–ΆΒΡΤϊ≥ΒΕ·ΝΠ»ΦΝœΘ§ΙΛ“Β…œΩ…Ά®ΙΐCOΚΆH2Μ·Κœά¥÷Τ±ΗΦΉ¥ΦΘΚ
Θ®1Θ©“―÷ΣΘΚΔΌH2(g)ΘΪ1/2O2(g)![]() H2O(l) ΠΛH1ΘΫΘ≠285.8 kJ/molΘΜ
H2O(l) ΠΛH1ΘΫΘ≠285.8 kJ/molΘΜ
ΔΎCO (g)ΘΪ1/2O2 (g)![]() CO2 (g) ΠΛH2=Θ≠283kJ/mol
CO2 (g) ΠΛH2=Θ≠283kJ/mol
ΔέCH3OH(g)ΘΪ3/2O2(g)![]() CO2(g)ΘΪ2H2O(l) ΠΛH3ΘΫΘ≠764.6 kJ/mol
CO2(g)ΘΪ2H2O(l) ΠΛH3ΘΫΘ≠764.6 kJ/mol
‘ρΙΛ“Β÷Τ±ΗΦΉ¥ΦΒΡΩ…ΡφΖ¥”Π»»Μ·―ßΖΫ≥Χ ΫΈΣ_______________________________ΘΜ
Θ®2Θ©ΚψΈ¬Κψ»ίΧθΦΰœ¬Θ§œ¬Ν–Οη ω÷–ΡήΥΒΟς…œ ωΖ¥”Π“―¥οΤΫΚβΉ¥Χ§ΒΡ «__________ΓΘ
AΘ°ΒΞΈΜ ±ΦδΡΎ…ζ≥…n mol COΒΡΆ§ ±…ζ≥…2n mol H2 BΘ°ΠΆ(H2)’ΐΘΫ2ΠΆ(CH3OH)Ρφ
CΘ°»ίΤςΡΎΤχΧεΒΡΟήΕ»±Θ≥÷≤Μ±δ DΘ°»ίΤς÷–ΤχΧεΒΡ―Ι«Ω±Θ≥÷≤Μ±δ
Θ®3Θ©Ρ≥Μ·―ß―–ΨΩ–‘―ßœΑ–ΓΉιΡΘΡβΙΛ“ΒΚœ≥…ΦΉ¥ΦΒΡΖ¥”ΠΘ§‘Ύ»ίΜΐΙΧΕ®ΈΣ2LΒΡΟή±’»ίΤςΡΎ≥δ»κ1 molCOΚΆ 2 molH2Θ§Φ”»κΚœ ¥ΏΜ·ΦΝΘ®ΧεΜΐΩ…“‘Κω¬‘≤ΜΦΤΘ©Κσ‘Ύ250ΓψCΩΣ ΦΖ¥”ΠΘ§COΈο÷ ΒΡΝΩΥφ ±Φδ±δΜ·»γœ¬ΘΚ
Ζ¥”Π ±Φδ/min | 0 | 5 | 10 | 15 | 20 | 25 |
nΘ®COΘ©/mol | 1.00 | 0.79 | 0.63 | 0.54 | 0.50 | 0.50 |
‘ρ¥”Ζ¥”ΠΩΣ ΦΒΫ20min ±Θ§“‘ΠΆΘ®H2Θ©=________Θ§ΗΟΈ¬Ε»œ¬ΤΫΚβ≥Θ ΐKΘΫ_______ΓΘ
Θ®4Θ©Φ”»κ¥ΏΜ·ΦΝΚσ‘Ύ250 ΓφΩΣ ΦΖ¥”ΠΘ§COΒΡΤΫΚβΉΣΜ·¬ ”κΈ¬Ε»ΓΔ―Ι«ΩΒΡΙΊœΒ»γΆΦΥυ ΨΓΘ
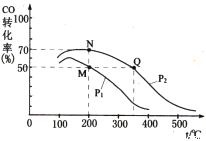
ΔΌMΓΔNΓΔQ»ΐΒψΒΡΤΫΚβ≥Θ ΐKMΓΔKNΓΔKQΒΡ¥σ–ΓΙΊœΒΈΣ___________________________ΓΘ
ΔΎ”…MΒψΒΫNΒψΗΡ±δΒΡΆβΫγΧθΦΰ «_________ΓΘ
AΓΔΫΒΒΆΈ¬Ε» BΓΔ‘ω¥σ―Ι«Ω
CΓΔΗΡ”ΟΗϋΚΟΒΡ¥ΏΜ·ΦΝ DΓΔΆ®»κΗϋΕύΒΡCO
Θ®5Θ©25Γφ ±“‘œΓΝρΥαΈΣΒγΫβ÷ »ή“Κ÷Τ≥…ΦΉ¥Φ»ΦΝœΒγ≥ΊΘ§‘ρΗΚΦΪΒΡΒγΦΪΖΫ≥Χ ΫΈΣ_________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈόΥ°MgBr2Ω…”ΟΉς¥ΏΜ·ΦΝΓΘΡ≥–Υ»Λ–ΓΉιΆ§―ß≤…”ΟΟΨ–Φ”κ“ΚδεΈΣ‘≠Νœ÷Τ±ΗΈόΥ°MgBr2Θ§…ηΦΤΉΑ÷Ο»γΆΦΥυ ΨΓΘ“―÷ΣΘΚMg”κBr2Ζ¥”ΠΨγΝ“Ζ≈»»ΘΜMgBr2ΨΏ”–«ΩΈϋΥ°–‘ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©

A.άδΡΐΙή÷–άδΥ°ΫχΓΔ≥ωΩΎΖΫœρ¥μΈσ
B. Β―ι÷–Ω…“‘”ΟΗ…‘οΒΡΩ’Τχ¥ζΧφΗ…‘οΒΡN2
C.ΈΣΖά÷ΙΖ¥”ΠΙΐ”ΎΨγΝ“Θ§≤ΜΡή”ΟΉΑ÷ΟC¥ζΧφΉΑ÷ΟB
D.ΉΑ”–ΈόΥ°CaCl2ΙΧΧεAΒΡΉς”Ο «Έϋ ’Μ”ΖΔΒΡδε’τΤχΘ§Ζά÷ΙΈέ»ΨΜΖΨ≥
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ2018Ρξ10‘¬15»’Θ§÷–Ιζ”ΟΓΑ≥Λ’ς»ΐΚ≈““Γ±‘Υ‘ΊΜπΦΐ≥…ΙΠ“‘ΓΑ“ΜΦΐΥΪ–«Γ±ΖΫ ΫΖΔ…δ±±ΕΖ»ΐΚ≈»Ϊ«ρΉιΆχΈά–«œΒΆ≥ΒΎ15ΓΔ16Κ≈Έά–«Θ§ΤδΜπΦΐΆΤΫχΦΝΈΣΗΏ¬»ΥαοßΘ®NH4ClO4Θ©Β»ΓΘ÷Τ±ΗNH4ClO4ΒΡΙΛ“’Νς≥Χ»γœ¬ΘΚ
±ΞΚΆ ≥―ΈΥ°![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
œ¬Ν–ΥΒΖ®¥μΈσΒΡ «
A. NH4ClO4 τ”ΎάκΉ”Μ·ΚœΈο
B. »ήΫβΕ»ΘΚNaClO4ΘΨNH4ClO4
C. ΒγΫβNaClO3»ή“Κ ±―τΦΪΖ¥”Π ΫΈΣClO3-ΘΪH2OΘ≠2e-=C1O4-ΘΪ2H+
D. ΗΟΝς≥Χ÷–Ω…―≠ΜΖάϊ”ΟΒΡΈο÷ «NH4Cl
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΛ“Β÷ΤΝρΥα÷–ΒΡ“ΜΗωΖ¥”ΠΘΚ2SO2(g)+O2(g)![]() 2SO3(g)Θ§œ¬Ν–”–ΙΊΥΒΖ®¥μΈσΒΡ «( )
2SO3(g)Θ§œ¬Ν–”–ΙΊΥΒΖ®¥μΈσΒΡ «( )
A.‘ΎΖ¥”ΠΧθΦΰœ¬Θ§SO2≤ΜΩ…Ρή100%ΉΣΜ·ΈΣSO3
B.¥οΒΫΤΫΚβ ±SO2ΒΡ≈®Ε»”κSO3≈®Ε»œύΒ»
C. Ι”Ο¥ΏΜ·ΦΝΡήΦ”ΩλΖ¥”ΠΥΌ¬
D.ΤΫΚβΚσ‘Ό…ΐΗΏΈ¬Ε»ΤΫΚβΜαΗΡ±δ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ¬»Μ·ΡΤ(NaCN) «“Μ÷÷Μυ±ΨΜ·ΙΛ‘≠ΝœΘ§Ά§ ±“≤ «“Μ÷÷ΕΨΈο÷ ΓΘ“ΜΒ©–Ι¬©–η“ΣΦΑ ±¥ΠάμΘ§“ΜΑψΩ…“‘Ά®Ιΐ≈γΨΤΥΪ―θΥ°ΜρΙΐΝρΥαΡΤ(Na2S2)»ή“Κά¥¥ΠάμΘ§“‘Φθ…ΌΕ‘ΜΖΨ≥ΒΡΈέ»ΨΓΘ
I.(1)NaCN”ΟΥΪ―θΥ°¥ΠάμΚσΘ§≤ζ…ζ“Μ÷÷Υα Ϋ―ΈΚΆ“Μ÷÷Ρή Ι Σ»σΒΡΚλ…Ϊ ·»ο ‘÷Ϋ±δάΕΒΡΤχΧεΘ§ΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ «___________________________________ΓΘ
II.ΙΛ“Β÷Τ±ΗΙΐΝρΥαΡΤΒΡΖ¥”Π‘≠άμ»γœ¬Υυ Ψ
÷ςΖ¥”Π:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3Γϋ+2H2O
Na2S2O8+2NH3Γϋ+2H2O
Η±Ζ¥”Π:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
Ρ≥Μ·―ß–ΓΉιάϊ”Ο…œ ω‘≠άμ‘Ύ Β―ι “÷Τ±ΗΙΐΝρΥαΘ§≤Δ”ΟΙΐΝρΥαΡΤ»ή“Κ¥ΠάμΚ§«ηΜ·ΡΤΒΡΖœΥ°ΓΘ
Β―ι“Μ: Β―ι “Ά®Ιΐ»γœ¬ΆΦΥυ ΨΉΑ÷Ο÷Τ±ΗNa2S2O8ΓΘ

(2)ΉΑ÷Ο÷– ΔΖ≈(NH4)2S2O8»ή“ΚΒΡ“«ΤςΒΡΟϊ≥Τ «____________ΓΘ
(3)ΉΑ÷Οa÷–Ζ¥”Π≤ζ…ζΒΡΤχΧε–η“Σ≥÷–χΆ®»κΉΑ÷ΟcΒΡ‘≠“ρ «____________________ΓΘ
(4)…œ ωΉΑ÷Ο÷–ΜΙ–η≤Ι≥δΒΡ Β―ι“«ΤςΜρΉΑ÷Ο”–______________(ΧνΉ÷ΡΗ¥ζΚ≈)ΓΘ
A.Έ¬Ε»ΦΤ BΥ°‘ΓΦ”»»ΉΑ÷Ο
C.œ¥ΤχΤΩ D.ΜΖ–Έ≤ΘΝßΫΝΑηΑτ
Β―ιΕΰ:≤βΕ®”ΟΙΐΝρΥαΡΤ»ή“Κ¥ΠάμΚσΒΡΖœΥ°÷–¬»Μ·ΡΤΒΡΚ§ΝΩΓΘ
“―÷Σ;ΔΌΖœΥ°÷–¬»Μ·ΡΤΒΡΉνΗΏ≈≈Ζ≈±ξΉΦΈΣ0.50mg/LΓΘ
ΔΎAg++2CNΓΣ===[Ag(CN)2]ΓΣΘ§Ag++IΓΣΘΫΘΫAgIΓΐΘ§AgI≥ ΜΤ…ΪΘ§CNΓΣ”≈œ»”κAg+ΖΔ…ζΖ¥”ΠΓΘ Β―ι»γœ¬:»Γ1L¥ΠάμΚσΒΡNaCNΖœΥ°Θ§≈®ΥθΈΣ10.00mL÷Ο”ΎΉΕ–ΈΤΩ÷–Θ§≤ΔΒΈΦ”ΦΗΒΈKI»ή“ΚΉς÷Η ΨΦΝΘ§”Ο1.0![]() 10ΓΣ3mol/LΒΡ±ξΉΦAgNO3»ή“ΚΒΈΕ®Θ§œϊΚΡAgNO3»ή“ΚΒΡΧεΜΐΈΣ5.00mL
10ΓΣ3mol/LΒΡ±ξΉΦAgNO3»ή“ΚΒΈΕ®Θ§œϊΚΡAgNO3»ή“ΚΒΡΧεΜΐΈΣ5.00mL
(5)ΒΈΕ®÷’ΒψΒΡœ÷œσ «___________________________________ΓΘ
(6)¥ΠάμΚσΒΡΖœΥ°÷–«ηΜ·ΡΤΒΡ≈®Ε»ΈΣ____________________mg/L.
Δσ.(7)≥ΘΈ¬œ¬Θ§Κ§ΝρΈΔΝΘΒΡ÷ς“Σ¥φ‘Ύ–Έ Ϋ ήpHΒΡ”ΑœλΓΘάϊ”ΟΒγΜ·―ß‘≠άμΘ§”ΟΕη–‘ΒγΦΪΒγΫβ±ΞΚΆNaHSO4»ή“Κ“≤Ω…“‘÷Τ±ΗΙΐΝρΥαΡΤΓΘ“―÷Σ‘Ύ―τΦΪΖ≈ΒγΒΡάκΉ”÷ς“ΣΈΣHSO4ΓΣΘ§‘ρ―τΦΪ÷ς“ΣΒΡΖ¥”Π ΫΈΣ_________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «Θ® Θ©
A. ι–¥Ι≤ΦέΜ·ΚœΈοΒΡΒγΉ” Ϋ÷Μ–ηΑ―ΫαΙΙ Ϋ÷–ΒΡ“ΜΗωΒΞΦϋΗΡ≥…“ΜΕ‘ΒγΉ”Φ¥Ω…
B.“―÷Σ![]() Θ§Ω…ΦϊΘ§≥…ΦϋΒΡ“ΜΖΫ≤ΜΧαΙ©ΒγΉ”“≤Ω…Ρή–Έ≥…Μ·―ßΦϋ
Θ§Ω…ΦϊΘ§≥…ΦϋΒΡ“ΜΖΫ≤ΜΧαΙ©ΒγΉ”“≤Ω…Ρή–Έ≥…Μ·―ßΦϋ
C.ΫΪΡ≥÷÷Μ·ΚœΈο»ή”ΎΥ°Θ§»τΡήΒΦΒγΥΒΟς’β÷÷Μ·ΚœΈο «άκΉ”Μ·ΚœΈο
D.÷Μ“Σ «άκΉ”Μ·ΚœΈοΤδ»έΒψΨΆ±»Ι≤ΦέΜ·ΚœΈοΒΡ»έΒψΗΏ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
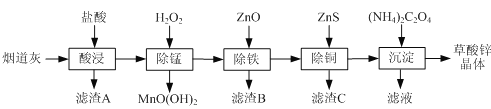
ΓΨΧβΡΩΓΩ“‘ΝΕ–Ω≥ßΒΡ―ΧΒάΜ“![]() ÷ς“Σ≥…Ζ÷ΈΣZnOΘ§ΝμΚ§…ΌΝΩ
÷ς“Σ≥…Ζ÷ΈΣZnOΘ§ΝμΚ§…ΌΝΩ![]() ΓΔCuOΓΔ
ΓΔCuOΓΔ![]() ΓΔMnOΒ»
ΓΔMnOΒ»![]() ΈΣ‘≠ΝœΩ……ζ≤ζ≤ίΥα–ΩΨßΧεZnSO4ΓΛ2H2OΘ§ΡΠΕϊ÷ ΝΩΈΣ189g/molΓΘ
ΈΣ‘≠ΝœΩ……ζ≤ζ≤ίΥα–ΩΨßΧεZnSO4ΓΛ2H2OΘ§ΡΠΕϊ÷ ΝΩΈΣ189g/molΓΘ
”–ΙΊ«β―θΜ·ΈοΩΣ Φ≥ΝΒμΚΆ≥ΝΒμΆξ»ΪΒΡpH»γœ¬±μΘΚ
«β―θΜ·Έο |
|
|
|
|
ΩΣ Φ≥ΝΒμΒΡpH |
|
|
|
|
≥ΝΒμΆξ»ΪΒΡpH |
|
|
|
|
«κΈ ¥πœ¬Ν–Έ ΧβΘΚ
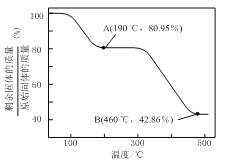
(1)¬Υ‘ϋAΒΡ÷ς“Σ≥…Ζ÷ΈΣ_________Θ§¬Υ‘ϋBΒΡ÷ς“Σ≥…Ζ÷ΈΣ_______________ΓΘ
(2)≥ΐΟΧΙΐ≥Χ÷–≤ζ…ζ![]() ≥ΝΒμΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_______________________ΓΘ
≥ΝΒμΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_______________________ΓΘ
(3) ΔΌ≥ΐΧζ![]() ≤ΩΖ÷
≤ΩΖ÷![]() Ω…Ρή±Μ≥ΐ»Ξ
Ω…Ρή±Μ≥ΐ»Ξ![]() ±Φ”»κZnOΩΊ÷ΤΖ¥”Π“ΚpHΒΡΖΕΈßΈΣ______________ΓΘ
±Φ”»κZnOΩΊ÷ΤΖ¥”Π“ΚpHΒΡΖΕΈßΈΣ______________ΓΘ
ΔΎ»τΡ≥»ή“Κ÷–Κ§”–![]() Θ§Ω…ΡήΚ§”–
Θ§Ω…ΡήΚ§”–![]() Θ§«κ…ηΦΤ Β―ι÷ΛΟς
Θ§«κ…ηΦΤ Β―ι÷ΛΟς![]() ΒΡ¥φ‘ΎΓΘ________ΓΘ
ΒΡ¥φ‘ΎΓΘ________ΓΘ
(4)≥ΝΒμΚσ“ΣΜώΒΟΗ…‘ο¥ΩΨΜ≤ίΥα–ΩΨßΧεΘ§–ηΫχ––ΒΡ≤ΌΉς «_______________ΓΘ
(5)ΫΪ≤ίΥα–ΩΨßΧεΦ”»»Ζ÷ΫβΩ…ΒΟΒΫ“Μ÷÷Ρ…ΟΉ≤ΡΝœΓΘΦ”»»Ιΐ≥Χ÷–ΙΧΧε≤–Ντ¬ ΥφΈ¬Ε»ΒΡ±δΜ·»γΆΦΥυ ΨΘ§![]() ΖΕΈßΡΎΘ§ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_________________ΓΘ
ΖΕΈßΡΎΘ§ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬ΆΦΈΣΖ¥”Π 2H2(g)ΘΪO2(g)=2H2O(g)ΒΡΡήΝΩ±δΜ· Ψ“βΆΦΓΘ œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
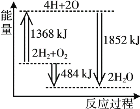
A.≤πΩΣ 2 mol H2(g)ΚΆ 1 mol O2(g)÷–ΒΡΜ·―ßΦϋ≥…ΈΣHΓΔO‘≠Ή”Θ§Ι≤Ζ≈≥ω1368 kJ ΡήΝΩ
B.”… HΓΔO ‘≠Ή”–Έ≥… 2 mol H2O(g)Θ§Ι≤Έϋ ’1852 kJ ΡήΝΩ
C.2 mol H2(g)ΚΆ 1 mol O2(g)Ζ¥”Π…ζ≥… 2 mol H2O(g)Θ§Ι≤Ζ≈≥ω484 kJ ΡήΝΩ
D.2 mol H2(g)ΚΆ 1 mol O2(g)Ζ¥”Π…ζ≥… 2 mol H2O(l)Θ§ΠΛHΘΨΘ≠484 kJΓΛmol-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com