
【题目】下列离子组在给定条件下能否大量共存的判断正确,所发生反应的离子方程式也正确的是
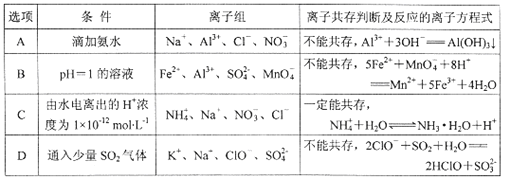
A. A B. B C. C D. D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室用固体烧碱配制0.1mol/L的NaOH溶液480mL,请回答:
(1)计算需要NaOH固体质量______g;
(2)有以下仪器:①烧杯②药匙 ③250mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平⑦量筒.配制时,必须使用的玻璃仪器______(填序号),还缺少的仪器是______;
(3)使用容量瓶前必须进行的一步操作是______;
(4)配制溶液时,在计算、称量、溶解、冷却后还有以下几个步骤,其正确的操作顺序为______(填序号);
①振荡摇匀;②洗涤;③定容;④颠倒摇匀;⑤转移
(5)配制过程中,下列操作会引起结果偏高的是______(填序号);
①未洗涤烧杯、玻璃棒;
②称量NaOH的时间太长;
③定容时俯视刻度;
④容量瓶不干燥,含有少量蒸馏水;
⑤NaOH溶液未冷却至室温就转移到容量瓶.
(6)某同学用浓硫酸配制的稀硫酸浓度偏低,则可能的原因是______(填序号)。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁后将洗涤液弃去
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容、摇匀后发现溶液的凹液面低于刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用18.4 mol/L的浓H2SO4来配制500 mL 0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是______________________。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
(3)将所配制的稀H2SO4进行测定,发现浓度大于0.2 mol/L。请你分析配制过程中可能引起浓度偏高的原因_____________________ (多选题)
A.定容时液面低于刻度线
B.未冷却到室温就定容
C.定容时液面高于刻度线
D.量取浓硫酸时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍—镉电池是一种可充电的“干电池”,使用寿命长达10~15年。镍—镉电池的总反应为Cd+2NiOOH+2H2O![]() 2Ni(OH)2+Cd(OH)2。下列说法不正确的是( )
2Ni(OH)2+Cd(OH)2。下列说法不正确的是( )
A. 放电时,负极发生了氧化反应,反应为Cd+2OH--2e-===Cd(OH)2
B. 充电时,阳极反应为Ni(OH)2(s)-e-+OH-(aq)===NiOOH(s)+H2O(l)
C. 电池工作时,负极区pH增大,正极区pH减小
D. 该电池充电时将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的分子式为C9H15OCl,分子中含有一个六元环和一个甲基,环上只有一个取代基;F分子中不含甲基:A与其它物质之间的转化如下图所示:
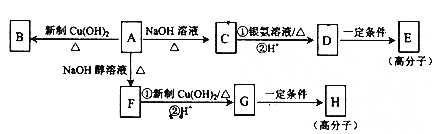
(1) A-F的反应类型是______________;G中含氧官能团的名称是____________。
(2)A-C的反应方程式是____________________。
(3)H的结构简式是____________________,E的结构简式是____________。
(4)有的同学认为B中可能没有氯原子,你的观点是________________(填“同意”或“不同意”)你的理由_______________。
(5)某烃的含氧衍生物X符合下列条件的同分异构体中,核磁共振氢谱显示为2组峰的是_____________(写结构简式);只含有两个甲基的同分异构体有____________种。
①相对分子质量比C少54 ;②氧原子数与C相同 ; ③能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 ph=5时沉淀完全).其中分析错误的是

A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②可用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤⑤ 的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其他产物已略去)。下列说法不正确的是
![]()
A. 若W是单质铁,则Z溶液可能是FeCl2溶液
B. 若W是氢氧化钠,则X与Z可反应生成Y
C. 若X是金属镁,则W可能是强氧化性的单质
D. 若X是金属Na,则Z可以是Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是
A. O2和S2O32-是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1:1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiAlH4( )、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
)、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
A. LiH与D2O反应,所得氢气的摩尔质量为4 g/mol
B. 1 mol LiAlH4在125℃完全分解,转移3 mol电子
C. LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4+ 2H2O![]() LiAlO2+ 4H2↑
LiAlO2+ 4H2↑
D. LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com