
| A. | 盐酸分别与氢氧化钠溶液、澄清石灰水反应 | |
| B. | 硫酸分别与氢氧化钠溶液、氢氧化钡溶液反应 | |
| C. | 硝酸分别与碳酸钠溶液、碳酸钾溶液反应 | |
| D. | 锌分别与稀盐酸、稀硫酸反应 |
分析 A.二者都是强酸与强碱反应生成可溶性盐和水的反应;
B.硫酸与氢氧化钡溶液反应除了生成水,还生成了硫酸钡 沉淀;
C.二者的反应实质都是2H++CO32-=H2O+CO2↑;
D.二者的离子方程式都是2H++Zn=Zn2++H2↑.
解答 解:A.盐酸分别与NaOH溶液、Ca(OH)2溶液,都强酸与强碱反应生成可溶性盐的反应,离子方程式都为:H++OH-=H2O,可以用同一离子方程式表示,故A不选;
B.硫酸分别与NaOH溶液是强酸与强碱反应生成可溶性盐的反应而Ba(OH)2溶液生成难溶的盐,前者的离子方程式为:H++OH-=H2O,后者为2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓,二者的离子方程式不同,故B选;
C.硝酸分别与Na2CO3溶液、K2CO3溶液反应,离子方程式都是氢离子和碳酸根离子反应生成水和二氧化碳,离子方程式均为2H++CO32-=H2O+CO2↑,故C不选;
D.Zn分别与稀盐酸、稀硫酸反应,都是活泼金属与氢离子的反应,离子方程式都为:2H++Zn=Zn2++H2↑,故D不选;
故选B.
点评 本题考查了离子方程式的书写方法,为高考的高频题,题目难度不大,明确离子方程式表示的意义为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的规范答题能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用过量的乙醇能使乙酸完全转化为乙酸乙脂 | |
| B. | 酯化反应时,生成的酯基个数与水分子个数相同 | |
| C. | 用过滤的方法分离乙酸乙酯和碳酸钠饱和溶液的混合物 | |
| D. | CH3CH(OH)COOH不能相互反应生成聚脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、蒸发皿 | 氯化钠溶液的蒸发结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去二氧化硅中的少量碳酸钙 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体硫酸钠配制0.1 mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:
秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 6:1 | C. | 1:5 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟胺中氮显-1价 | |
| B. | 羟胺的电子式为 | |
| C. | 硫酸羟胺的化学式为(NH3OH)2SO4 | |
| D. | 羟胺的电离方程式为NH2OH?NH2O-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述反应的产物Cu2HgI4中,Hg的化合价为+2 | |
| B. | 上述反应中CuI既是氧化剂,又是还原剂 | |
| C. | 上述反应中Hg与Cu均发生氧化反应 | |
| D. | 上述反应中生成64gCu时,转移的电子数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
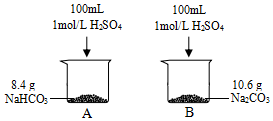 某小组同学在实验室研究Na2CO3与NaHCO3的性质.
某小组同学在实验室研究Na2CO3与NaHCO3的性质.| 实验步骤 | 实验现象 |
| ⅰ.取1mL 0.1mol/L NaHCO3溶液,向其中加入 1mL 0.01mol/L CaCl2溶液 | 无明显现象 |
| ⅱ.向上述溶液中滴加NaOH溶液 | 产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 磨口玻璃试剂瓶不能盛装烧碱溶液:SiO2+2Na++2OH-=Na2SiO3↓+H2O | |
| C. | 草酸溶液使酸性高锰酸钾溶液褪色:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 检验FeCl2 溶液未完全氧化变质:3Fe2++2[Fe(SCN)6]3-═Fe3[Fe(SCN)6]2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com