
具有下列电子排布式的原子中,半径最大的是 ( )
A ls22s22p63s23p5 B 1s22s22p63s23p2 C 1s22s22p2 D 1s22s22p63s23p4
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列六种基团:①苯基 ②醛基 ③羟基 ④羧基 ⑤乙基 ⑥氯原子(-Cl)这六种基团两两结合,可形成新的化合物,写出符合下列条件的化合物的结构简式。
(1)分子内氧原子数不超过2个,具有酸性,但不能和碳酸氢钠反应 。
(2)分子内氧原子数不超过2个,能发生银镜反应的物质,除苯甲醛和甲酰氯(Cl-CHO)外还有 、 。
(3)不稳定的两元弱酸 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
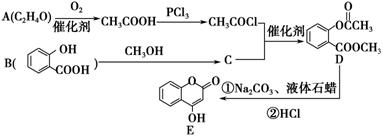
(1)A中含有的官能团名称为________。
(2)C转化为D的反应类型是________。
(3)写出D与足量NaOH溶液完全反应的化学方程式:____________________。
(4)1 mol E最多可与________mol H2加成。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:____________。
A.能发生银镜反应 B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应,水解时1 mol可消耗3 mol NaOH
(6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯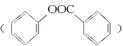 是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。合成路线流程图示例如下:
是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。合成路线流程图示例如下:
H2C==CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
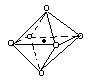
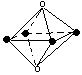
下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的图象是
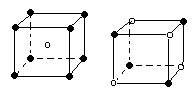 | |||||
 | |||||
 | |||||
⑴ ⑵ ⑶ ⑷
A.图⑴和图⑶ B.图⑵和图⑶ C.只有图⑴ D.图⑴和图⑷
查看答案和解析>>
科目:高中化学 来源: 题型:
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Z与X形成只含一个中心原子的共价化合物,则它的分子式是 ,其分子的立体结构是 。
(2)Y的最高价氧化物晶体类型是 晶体。X的氧化物与Y的最高氧化物中,分子极性较小的是(填分子式) 。
(3)右图是W的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。(图中实心球表示W元素)
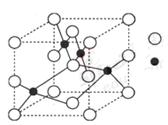
(4)铜元素和W元素都位于周期表的ds区,胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 ·H2O,其结构示意图如右,有关它的说法正确的是 ________(填字母)。
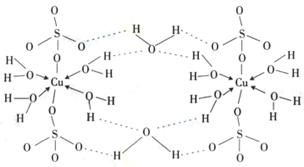
A.该胆矾晶体中存在配位键、共价键和离子键
B.该结构中还存在金属键,极性共价键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
.T1℃时,向容积为2 L的密闭容器中 充入一定量的A气体和B气体,发生如下反应:
充入一定量的A气体和B气体,发生如下反应:
A(g)+2B(g) C(g)
C(g)
反应过程中测定的部分数据见下表:
| 反应时间/min | n(A)/mol | n(B)/ mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
下列说法正确的是
A.前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液能与铝反应放出氢气,则该溶液中肯定不能大量共存的离子组是
A.NH4+、Na+、Ba2+、Cl- B.Na+、I-、HCO3-、SO42-
C.K+、Cl-、SO32-、AlO2- D.Na+、Mg2+、SO42-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com