
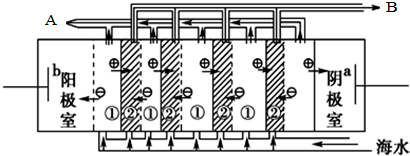
 ,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.
,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
分析 (1)在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,则水中的氢离子在阴极放电;
(2)海水晒盐需要浓缩、蒸发、结晶;建盐田必须在阳光充足、平坦空旷的地方;
(3)①检测Fe3+是否除尽,选择KSCN试剂观察是否出现血红色;
②过程I除去钡离子,由表格数据可知硫酸钡比碳酸钡更难溶;
(4)制取纯碱,第一步中NaCl、CO2 和 NH3 为原料反应生成碳酸氢钠和氯化铵;
(5)测定样品中NaCl的质量分数,由流程可知,固体ng为碳酸钡的质量,由ngBaCO3~Na2CO3计算碳酸钠的质量,再计算NaCl质量分数.
解答 解:(1)在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,则水中的氢离子在阴极放电,则阴极生成氢气,同时生成NaOH,故答案为:氢气、氢氧化钠;
(2)海水晒盐需要浓缩、蒸发、结晶,则盐田分为贮水池、蒸发池和结晶池;建盐田必须在阳光充足、平坦空旷的地方,则选B.多风少雨、C.潮汐落差大且又平坦空旷的海滩,与A无关,故答案为:蒸发;BC;
(3)①检测Fe3+是否除尽的方法为取过程Ⅳ的滤液于试管中,向其中滴加KSCN溶液,若溶液不变色证明Fe3+已经沉淀干净,反之没除净,故答案为:取过程Ⅳ的滤液于试管中,向其中滴加KSCN溶液,若溶液不变色证明Fe3+已经沉淀干净,反之没除净;
②过程I除去钡离子,由表格数据可知硫酸钡比碳酸钡更难溶,则选用BaCl2而不选用CaCl2的原因为BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全,故答案为:BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全;
(4)制取纯碱,第一步中NaCl、CO2 和 NH3 为原料反应生成碳酸氢钠和氯化铵,该反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,故答案为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(5)测定样品中NaCl的质量分数,由流程可知,固体ng为碳酸钡的质量,由BaCO3~Na2CO3可知碳酸钠的质量为$\frac{106n}{197}$g,则样品中NaCl质量分数为$\frac{(m-\frac{106n}{197})}{m}$×100%=(1-$\frac{106n}{197m}$)×100%,故答案为:(1-$\frac{106n}{197m}$)×100%.
点评 本题考查混合物分离提纯的综合应用、海水资源利用及含量计算等,侧重于学生的分析能力的考查,为高考常见题型,注意把握分离流程中的反应及混合物分离方法为解答该类题目的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作干燥剂 | |
| B. | 二氧化硅可用作计算机的芯片 | |
| C. | 硅酸钠是制备木材防火剂的原料 | |
| D. | 用纯碱、石灰石、石英为原料可制普通玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
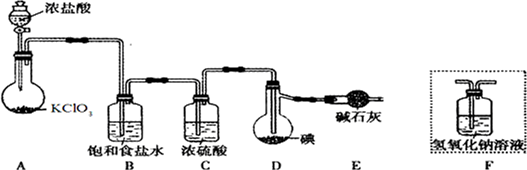
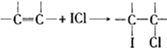
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
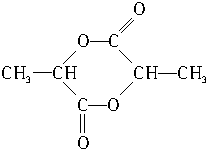 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1mol化合物Ⅰ能与4molH2发生完全加成反应
1mol化合物Ⅰ能与4molH2发生完全加成反应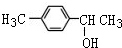 或
或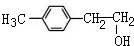 (写1种即可);由Ⅲ生成Ⅰ的反应条件为NaOH的乙醇溶液,加热.
(写1种即可);由Ⅲ生成Ⅰ的反应条件为NaOH的乙醇溶液,加热.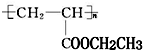 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3;利用类似反应①的方法,以乙烯和乙醇为有机物原料合成该单体,该反应的化学方程式为2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3;利用类似反应①的方法,以乙烯和乙醇为有机物原料合成该单体,该反应的化学方程式为2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取在空气中久置的碳酸钠晶体143.0g | |
| B. | 定容时,仰视观察刻度线 | |
| C. | 转移溶液时,用于溶解碳酸钠晶体的烧杯没有洗涤 | |
| D. | 定容后,将容量瓶震荡摇匀,静置时发现液面低于刻度线,于是又加少量水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com