

 知,还需要测定产生40mL气体所需的时间,
知,还需要测定产生40mL气体所需的时间, 2H2O+O2↑,
2H2O+O2↑, 2H2O+O2↑;
2H2O+O2↑; 知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,故答案为:D>C>B>A;
知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,故答案为:D>C>B>A; 2H2O+O2↑
2H2O+O2↑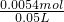 =0.11 mol?L-1,故答案为:0.11mol/L.
=0.11 mol?L-1,故答案为:0.11mol/L. 分析;
分析; 比较反应速率快慢;
比较反应速率快慢; 计算物质的量浓度.
计算物质的量浓度. 来设计实验,通过得到气体的体积和时间的关系确定影响反应速率的因素,难度中等.
来设计实验,通过得到气体的体积和时间的关系确定影响反应速率的因素,难度中等. 

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 3n |
| 4 |
| 3n |
| 4 |
| 3n |
| 4 |
| 3n |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2+ 0.45 |
3+ 0.5 |
2+ 0.25 |
3+ 0.70 |
2+ 0.15 |
3+ 0.80 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省九校高三第二次联考理综化学试卷(解析版) 题型:填空题
短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,B是形成化合物种类最多的元素。

请回答下列问题:
(1)描述D在元素周期表中的位置:_____________________
(2)比较A、C、D元素简单离子半径的大小:______>______>______(填微粒符号)
(3)E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学反应方程式为_______________________________________________.
(4)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:______________;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出阳离子的电子式:________,写出该阳离子与F氢化物的水溶液反应的离子方程式:__________________________________________________________。
(5)在Fe和Cu 的混合物中加入一定量的C的最高价氧化物的水化物稀溶液,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分反应后,剩余金属m2g。下列说法正确的是( )
A.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Cu2+
B.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Fe2+
C.m1一定大于m2
D.剩余固体m1g中一定有单质铜,剩余固体m2g中一定没有单质铜

查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期期中考试化学试卷(解析版) 题型:填空题
(13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有 种,属于d区的元素有 种。第二周期元素中除Ne外电负性由高到低的三种元素依次是 ,电离能由高到低的三种元素依次是 。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元素 |
Mn |
Fe |
|
|
电离能 ( kJ·mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个 电子难。对此,你的解释是:_____________________________
【解析】(1)考查元素周期表的结构和原子核外电子的排布规律。根据构造原理可知4s轨道上只有1个电子的元素是K、Cr和 Cu。
(2)除ds区外,区的名称来自于构造原理最后填入电子的能级的符号,即s区包括第IA和ⅡA,共2列。p区包括第ⅢA到第 ⅦA以及0族,共6列。D区包括第3列到第10列,共8列。ds区包括第11和12列,共2列。非金属性越强,电负性越大,第一电离能也越大,非金属性是Cl>S>P,所以电负性是Cl>S>P。由于P原子的3p轨道属于半充满,属于第一电离能是Cl>P>S。
(3)根据构造原理可以写出锰元素的电子排布,即1s22s22p63s23p63d54s2,Fe2+的电子排布图为1s22s22p63s23p63d6。由于Mn2+的3d轨道属于半充满,比较稳定,所以再失去1个电子所需要的能量就高。而Fe2+的3d轨道上有6个电子,Fe3+的3d轨道上有5个电子,属于不充满比较稳定,因此3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com