
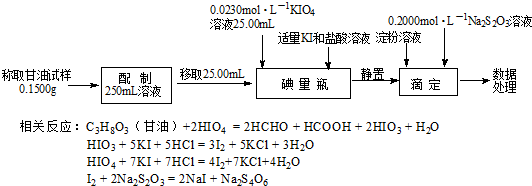
分析 Ⅰ.(1)根据电子得失守恒可知,将I2氧化为HIO4时,有关系式I2~7Cl2,根据碘的质量可计算出氯气的量;
(2)根据碘元素守恒可知,1.270g I2氧化为高碘酸时,HIO4的物质的量为$\frac{1.270g}{254g/mol}$=0.005mol,同时生成氯化氢的物质的量为0.07mol,与氢氧化钾反应的关系式为7HCl~HIO4~KOH,据此计算氢氧化钾溶液的体积;
Ⅱ.(3)碘溶液中有淀粉,所以溶液呈蓝色,用Na2S2O3标准溶液滴定达到滴定终点时溶液的蓝色会褪去,据此判断;
(4)根据题中的反应方程式可得关系式C3H8O3~$\frac{1}{2}$HIO3,I2~2Na2S2O3,3n(HIO3)+4n(HIO4)=n(I2),
碘量瓶中n(HIO3)+ n(HIO4)=n(KIO4)=0.0230 mol•L×25.00mL×10-3 L•mL=5.750×10-4 mol…①
滴定时:3n(HIO3)+4n(HIO4)=n(I2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×0.2000 mol•L×20.00mL×10-3 L•mL-1=2.000×10-3 mol…②
根据①②可求得与C3H8O3反应的HIO3,根据HIO3的物质的量可计算出甘油的质量,进而确定样品的纯度;
解答 解:Ⅰ.(1)根据电子得失守恒可知,将I2氧化为HIO4时,有关系式I2~7Cl2,1.270g 碘的质量为$\frac{1.270g}{254g/mol}$=0.005mol,所以消耗的氯气的物质的量为0.035mol,其体积为0.035mol×22.4L/mol=0.784L,
故答案为:0.784;
(2)根据碘元素守恒可知,1.270g I2氧化为高碘酸时,HIO4的物质的量为$\frac{1.270g}{254g/mol}$×2=0.01mol,同时生成氯化氢的物质的量为0.07mol,与氢氧化钾反应的关系式为7HCl~HIO4~KOH,所以氢氧化钾溶液的体积为$\frac{0.01mol}{0.200mol•{L}^{-1}}$×8=0.05L×8=400mL,
故答案为:400;
Ⅱ.(3)碘溶液中有淀粉,所以溶液呈蓝色,所以用Na2S2O3标准溶液滴定,判断达到滴定终点的现象是滴入最后一滴标准液时,溶液蓝色刚好褪去,且保持30秒不恢复原来的颜色,
故答案为:滴入最后一滴标准液时,溶液蓝色刚好褪去,且保持30秒不恢复原来的颜色;
(4)根据题中的反应方程式可得关系式C3H8O3~$\frac{1}{2}$HIO3,I2~2Na2S2O3,3n(HIO3)+4n(HIO4)=n(I2),
碘量瓶中n(HIO3)+ n(HIO4)=n(KIO4)=0.0230 mol•L×25.00mL×10-3 L•mL=5.750×10-4 mol…①
滴定时:3n(HIO3)+4n(HIO4)=n(I2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×0.2000 mol•L×20.00mL×10-3 L•mL-1=2.000×10-3 mol…②
①×4-②得 n(HIO3)=3.000×10-4 mol
n(C3H8O3)=$\frac{1}{2}$n(HIO3)=1.500×10-4 mol
w(C3H8O3)=$\frac{1.5×1{0}^{-4}×92×10}{0.150}$×100%=92.00%,
答:甘油样品的纯度为92.00%.
点评 本题以高碘酸钾的制备以及测定甘油的含量为载体,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,内容涉及方程式计算、氧化还原滴定、实验基本操作等,难度中等,是对知识的综合运用和能力的考查.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收足量的SO2气体:2OH-+SO2═SO32-+H2O | |
| B. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| D. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度时水溶液碱性:NaHCO3>Na2CO3 | |
| B. | 热稳定性:NaHCO3>Na2CO3 | |
| C. | 与盐酸溶液反应的速率(快慢):NaHCO3<Na2CO3 | |
| D. | 等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,NaHCO3产生的CO2多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com