
【题目】(1)对于下列反应:2SO2(g) + O2(g)![]() 2SO3(g) ,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为_________,用O2浓度变化来表示的反应速率为_________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
2SO3(g) ,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为_________,用O2浓度变化来表示的反应速率为_________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________;
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________;

(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将_______(容器不与外界进行热交换,填“升高”或“降低”)。
【答案】 2mol/(L·min) 1mol/(L·min) 2mol/L 升温 减小SO3浓度 降低
【解析】(1)v(SO2)=( 6 mol/L-2 mol/L)÷2min=2mol/(L·min),根据物质的反应速率之比等于物质的化学计量数之比可得 v(O2)= v(SO2)/2=1mol/(L·min);2min内O2浓度的减少量为0.5mol/(L·min)×2min=1mol/L,则SO2浓度的减少量为2×1mol/L=2 mol/L,所以2min时SO2的浓度为4mol/L-2 mol/L=2 mol/L。
(2)a时刻,正逆反应速率都增大,且逆反应速率增大的程度大于正反应速率增大的程度,a~b过程中改变的条件可能是升温;b时刻,正反应速率不变,逆反应速率减小,b~c过程中改变的条件可能是减小SO3浓度。
(3)扩大体积相当于减小压强,上述平衡逆向移动,反应吸热,所以容器内温度降低。


科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,海水中所含食盐高达4×1016t。用海水可生产食盐和金属镁或镁的化合物,其过程如下图所示。
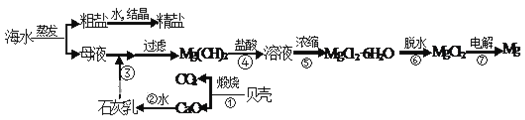
请回答
(1)贝壳主要成分的化学式_________________;
(2)步骤④反应的离子方程式____________________________________________;
(3)实验室由粗盐结晶制精盐的操作包括溶解、过滤、蒸发等步骤,
A.粗盐提纯过程中过滤的目的是____________(填序号)
①获得NaCl晶体 ②除去难溶性物质 ③除去易挥发物质 ④除去可溶性物质
B.过滤需要用到的玻璃仪器有玻璃棒______________、______________。
(4)电解MgCl2制金属Mg的反应方程式为MgCl2![]() Mg+Cl2↑。电解0.2molMgCl2可生成金属Mg_______g,同时可得到氯气__________L(标准状况)。
Mg+Cl2↑。电解0.2molMgCl2可生成金属Mg_______g,同时可得到氯气__________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F( )为一种高分子树脂,其合成路线如下:
)为一种高分子树脂,其合成路线如下:

已知:①A为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;
②
请回答下列问题:
(1)X的化学名称是_________________。
(2)E生成F的反应类型为_________________。
(3)D的结构简式为_________________。
(4)由B生成C的化学方程式为_________________。
(5)芳香族化合物Y是D的同系物,Y的同分异构体能与饱和Na2CO3溶液反应放出气体,分子中只有1个侧链,核磁共振氢普显示有5种不同化学环境的氢,峰值面积比为6:2:2:1:1。写出两种符合要求的Y的结构简式___________、__________。
(6)写出以甲醛、丙醛和乙二醇为主要原料合成软质隐形眼镜高分子材料—聚甲基丙烯酸羟乙酯( )的合成路线(无机试剂自选):_________________。
)的合成路线(无机试剂自选):_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】括号内物质为杂质,下列除去杂质的方法不正确的是( )
A.乙醇(水):先加生石灰后蒸馏
B.溴苯(溴):用NaOH溶液洗涤后分液
C.乙烷(乙烯):用溴水洗气
D.乙酸乙酯(乙酸):用NaOH溶液洗涤后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A. υ(A)= 0.5 mol/(L·s)
B. υ(B)= 0.3 mol/(L·s)
C. υ(C)= 0.8 mol/(L·s)
D. υ(D)= 1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三元素的原子具有相同的电子层数,其最高价氧化物对应的水化物分子组成和酸性相对强弱为:H3XO4<H2YO4<HZO4;X、Y、Z所形成氢化物还原性相对强弱正确的是( )
A.H2Z>H2Y>H2XB.XH3>H2Y>HZ
C.H2Z>YH3>XH4D.HZ>H2Y>XH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含FeCl2杂质的CuCl2·2H2O晶体,为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
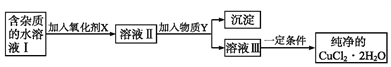
已知:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)得到溶液II,需加入氧化剂X, 加入氧化剂X的目的是____________________________。最适合作氧化剂X的是_________(填编号)。A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入试剂Y,调节溶液的pH范围是__________。下列中不适合作试剂Y的是_______(填编号)。
A.CuO B.Cu(OH)2 C.CuCO3 D.氨水
(3)由溶液Ⅲ得到CuCl2·2H2O晶体的操作是________________________________,过滤,洗涤,干燥。
(4)已知:某难溶物M(OH)3的Ksp=1×10-35 。若要使M3+沉淀完全,溶液的pH最小为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com