
【题目】(10分)下图是实验室制取、提纯氯气及研究氯气性质的装置图。请回答:

(1)上图实验室制备氯气的化学反应方程式为 。
(2)通常用向上排空气法或者排饱和食盐水法收集氯气,若要利用C瓶收集到干燥纯净的氯气,B瓶所装的试剂是 。(填名称)
(3)若D瓶中装有硝酸银溶液,则观察到的现象是 。
(4)E装置用来 ,写出E装置中发生化学反应的离子方程式 。
【答案】(1)化学反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 。
MnCl2+Cl2↑+2H2O 。
(2)B瓶所装的试剂是 浓硫酸 。
(3)现象是 有白色沉淀生成 。
(4) E装置用来 吸收尾气,防止污染空气 ,
离子方程式 Cl2 + 2OH- = Cl- + ClO- + H2O
【解析】
试题(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(2)制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体,食盐水中含有氯离子,能抑制氯气的溶解,所以除去氯气中的氯化氢应用饱和食盐水,干燥氯气用浓硫酸,即A瓶所装的试剂是饱和食盐水,B瓶所装的试剂是浓硫酸;(3) Cl2溶于水产生Cl-,与硝酸银溶液反应生成氯化银沉淀;(4) 氯气有毒,污染环境,所以不能直接排到空气中,可用氢氧化钠吸收多余的氯气,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
MnCl2+Cl2↑+2H2O;(2)制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体,食盐水中含有氯离子,能抑制氯气的溶解,所以除去氯气中的氯化氢应用饱和食盐水,干燥氯气用浓硫酸,即A瓶所装的试剂是饱和食盐水,B瓶所装的试剂是浓硫酸;(3) Cl2溶于水产生Cl-,与硝酸银溶液反应生成氯化银沉淀;(4) 氯气有毒,污染环境,所以不能直接排到空气中,可用氢氧化钠吸收多余的氯气,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。


科目:高中化学 来源: 题型:
【题目】(1)在试管Ⅰ和Ⅱ中分别加入3mL稀盐酸(均足量),再将装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在Ⅰ和Ⅱ的管口。各将气球内的NaHCO3、Na2CO3同时倒入试管中,回答:
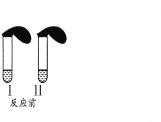
①I试管发生的离子方程式: _______________________;
②两支试管中充分反应后生成的气体总量Ⅰ_____Ⅱ,反应结束时消耗盐酸的物质的量Ⅰ_____Ⅱ(填“>”“=”或“<”)。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。乙同学认为甲同学的判断太武断,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
1 | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
2 | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
3 | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
4 | 35mL稀盐酸 | 含3.2gNa2CO3饱和溶液15mL[来 | 20℃ | 24.2℃ |
5 | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | T℃ |
6 | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出:
①Na2CO3的饱和溶液和盐酸的反应是___________(吸热或放热)反应;
②NaHCO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应;
③表中⑤号试验混合后温度T℃可能是(填编号)_________________________。
A.18.5℃ B. 24.2℃ C.16.2℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。如图是一种微生物燃料电池的工作原理示意图,下列有关说法不正确的是
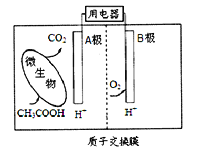
A. B电极是正极
B. 电池内H+从左侧向右侧迁移
C. A电极的电极反应式: CH3COOH + 8e-+ 2H2O=2CO2 +8H+
D. 该电池可利用有机废水等有机废弃物作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某黑色物质甲只含两种元素,为探究物质甲的组成和性质,设计并完成如下实验。其中气态氢化物乙在标况下的密度为 1.518 gL-1,甲和乙中相同元素的化合价相同。

(1)甲的化学式 ______________。
(2)写出白色沉淀转变为红褐色沉淀的化学方程式 ___________________________。
(3)将气体乙在过量空气中充分燃烧后的混合气体通入 BaCl2 溶液,出现白色沉淀。写出燃烧后的混合气体通入BaCl2 溶液产生白色沉淀的离子方程式 ___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的认识正确的是
A. 第IA 族元素又可称为碱金属元素 B. 每一族只有一列
C. 0 族元素的原子最外层均有8 个电子 D. 前3 个周期为短周期、其余为长周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表前四周期的一部分,下列关于元素X、Y、Z、W的说法正确的是( )
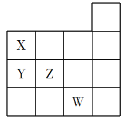
①X、Y的最高价氧化物对应水化物的酸性:Y<X
②Y、Z的气态氢化物的稳定性:Y<Z
③W的单质是常温下唯一的液态非金属,与铁粉反应可以生成Fe3+
④W的原子序数比Z大19
A. ①B. ①②
C. ①②③D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维(结构简式为![]() ),下列说法不正确的是( )
),下列说法不正确的是( )

A. 羊毛与聚酯纤维的化学成分不相同
B. 聚酯纤维和羊毛一定条件下均能水解
C. 该聚酯纤维单体为对苯二甲酸和乙二醇
D. 由单体合成聚酯纤维的反应属于加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.掌握仪器的名称、组装及使用方法是中学化学实验的基础,观察下图实验装置。
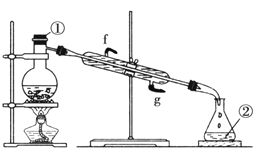
(1)写出图中玻璃仪器的名称:①______________,②______________。
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器有___________。
Ⅱ.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO47H2O)通过下列反应制备:FeSO4+Na2CO3 = FeCO3↓+Na2SO4 FeCO3+C6H8O7 = FeC6H6O7+CO2↑+H2O。
(1)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_____________。
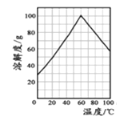
(2)结合如图绿矾溶解度曲线,要从FeSO4溶液中得到FeSO47H2O晶体,先通过____得到_____℃饱和溶液,再冷却至_____℃结晶,过滤,少量冰水洗涤,低温干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com