
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
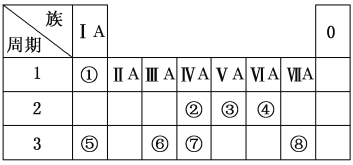
(1)②、④元素的原子按1∶2组成化合物的电子式:(用元素符号表示)_________________。
(2)⑤、⑧元素的化合物的用电子式表示形成过程:___________________________。
(3)①、⑤、⑥阳离子氧化性由弱到强的顺序是(用离子符号表示)_____________。
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
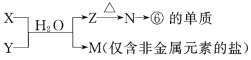
X溶液与Y溶液反应的离子方程式为___________________________________
【答案】![]()
![]() Na+、Al3+、H+
Na+、Al3+、H+ ![]() ab Al3++3NH3·H2O=Al(OH)3↓+3NH4+
ab Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
由元素在周期表中的位置确定元素,进而由元素单质及其化合物的性质回答问题。
(1)元素②、④按原子数1∶2组成化合物是CO2,它是原子间通过共用电子对形成的共价化合物,电子式是![]() 。
。
(2)元素⑤、⑧形成的化合物是NaCl,用电子式表示其形成过程为![]() 。
。
(3)通常,单质的还原性强,则对应离子的氧化性弱。①、⑤、⑥阳离子分别为H+、Na+、Al3+,氧化性由弱到强的顺序是Na+、Al3+、H+。
(4)要有离子键须有阴阳离子,要有极性共价键须不同种元素的原子间形成共用电子对。①、④、⑤形成NaOH符合,电子式是![]() 。
。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物有苯(C6H6)、双氧水(H2O2)等,稀溶液易被催化分解的是H2O2,可使用的催化剂有ab。H2O2与Na2SO3或KMnO4发生氧化还原反应,分别作氧化剂、还原剂。
(6)⑥的单质为Al,据图中转化关系N为Al2O3、Al(OH)3。仅含非金属元素的盐通常为铵盐,结合表中元素,知M为NH4Cl。故X溶液与Y溶液反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。


科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活,汽车尾气所排放的氮氧化物及燃煤所排放的硫氧化物是造成雾霾的重要原因。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:

如图是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为________________。

(2)改善能源结构是治理雾霾问题的最直接有效途径。二甲醚是一种清洁能源,可用合成气在催化剂存在下制备二甲醚,其反应原理为:
2CO(g)+4H2(g)![]() CH3OCH3 (g)+H2O(g) ΔH
CH3OCH3 (g)+H2O(g) ΔH
已知在一定条件下,该反应中CO的平衡转化率α随温度、投料比![]() 的变化曲线如图3所示。
的变化曲线如图3所示。

① a、b、c按由大到小的顺序排序为_______________;ΔH_____0(填“>”“<”或“=”)。
② 对于气相反应,用某组分(B)的平衡分压p(B)代替物质的量浓度c(B)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=_________________________。
③ 在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_____。
A.一氧化碳的转化率减小
B.容器的压强增大
C.化学平衡常数K值减小
D.逆反应速率先增大后减小
E.混合气体的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、D为常见单质,各物质发生如下框图所示变化,回答下列问题:
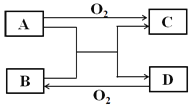
(1)若A、D为短周期同主族非金属元素的单质,则A元素在周期表中的位置为______,D的晶体类型是______,请写出A+B→C+D的化学方程式______。
(2)若B为气体,其标准状况下密度为1.964gL-1,C为白色固体,可用来制作耐高温材料。则B的电子式为______,C中含有的化学键是______(填写“离子键或者共价键”)。
(3)若A为生产生活中用量最大的金属,B在常温下为无色液体,写出C(金属元素有两种不同化合价)与盐酸反应的离子反应方程式____________。若以A和石墨棒为电极,NaCl溶液为电解质溶液构成原电池,请写出石墨电极的电极反应式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) △H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

A. 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ表示的是t1时刻通入氦气增大体系压强对反应速率的影响
C. 图Ⅱ表示的t1时刻加入催化剂后对反应速率的影响
D. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施是为了降低化学反应速率的是
A.食品放在冰箱中贮藏B.工业炼钢用纯氧代替空气C.合成氨工业中使用催化剂D.在加热条件下,用氢气还原氧化铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com