
某氯化镁溶液的密度为1.18 g/cm,其中镁离子的质量分数为5.1%。300 mL该溶液中Cl-的物质的量约为( )
A.0.37 mol B.0.63 mol C.0.74 mol D.1.5 mol
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
恒温恒容条件下,能使A(g)+B(g) C(g)+D(s) 正反应速率加快的是
C(g)+D(s) 正反应速率加快的是
A.减少C或D的物质的量
B.体积不变充入氦气
C.减少B的物质的量
D.增大A或B的物质的量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学试卷(解析版) 题型:填空题
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
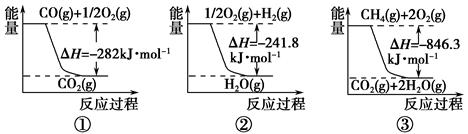
反应①②③均为____________反应(填“吸热”或“放热”)。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。为进一步提高CO2
CO(NH2)2(l)+H2O(g)。为进一步提高CO2
的平衡转化率,下列措施中能达到目的的是____________。
A.增大NH3的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
(3)尿素在农业生产中起重要作用,其合成过程分两步进行:
2NH3(g)+CO2(g) NH2COONH4(l)△H=-117kJ·mol-1
NH2COONH4(l)△H=-117kJ·mol-1
NH2COONH4(l) (NH2)2CO(g)+H2O(g)△H=+15kJ·mol-1
(NH2)2CO(g)+H2O(g)△H=+15kJ·mol-1
①第一步反应在11.1Mpa、160℃的条件下反应较快,转化率也较高,第二步反应在相同条件下反应速率较慢,转化率也较低.因此,总反应的反应速率和转化率主要取决于___________.(填“第一步”或“第二步”)
②对于第一步反应,不能判断该反应一定达到化学平衡状态的依据是__________(填字母).
A.容器中气体的平均相对分子质量不随时间而变化
B.υ(NH3)正=2υ(CO2)逆
C.恒容容器中气体的密度不随时间变化而变化
D.容器中各物质总质量不随时间变化而变化
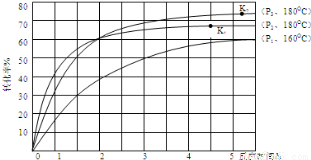
③第一步反应生成了1mol氨基甲酸铵,再发生第二步反应时的转化率与温度、压强的关系如图所示:
在180℃的条件下,P2_________P3(填“>”、“<”或“=”,下同);化学平衡常数K1_________K2.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学试卷(解析版) 题型:选择题
下图表示反应A(g)+B(g) nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )
nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )
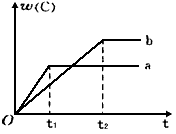
A.反应起始由逆反应开始建立平衡
B.a表示有催化剂,b表示无催化剂
C.若n=2,其它条件相同,a比b的压强大
D.若其它条件相同,a比b的温度高
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高一上学期期中化学卷(解析版) 题型:实验题
工业酒精是含水约4%的液态乙醇。向工业酒精中加入生石灰,会发生如下化学反应:CaO+H2O=Ca(OH)2,生成物分解温度较高且不溶于乙醇。
(1)要在实验室中将工业酒精转化为无水乙醇,下列做法中最佳的是________(填字母序号)。
A.加入过量的生石灰后过滤
B.加入过量的生石灰后蒸馏
C.加入过量的生石灰后分液
(2)在上述需要加热的实验方法中,需要用到的玻璃仪器,除酒精灯外,还有____________。在该方法的实验步骤里,在加热之前的操作是________,并且对此要注意的问题是________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高一上学期期中化学卷(解析版) 题型:选择题
下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 | 混合物[来源 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 食盐水 | 氯化铜 | 碳酸钠 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高一上学期期中化学卷(解析版) 题型:选择题
瓦斯中甲烷与氧气的质量比为1∶4时极易爆炸,此时甲烷与氧气的体积比为
A. 1∶4 B.1∶2 C. 1∶1 D.2∶1
1∶1 D.2∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上学期期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加
B.对于有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
C.改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率
D.对于本来不能发生的化学反应,改变条件可以使反应发生
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上月考一化学试卷(解析版) 题型:填空题
生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图。
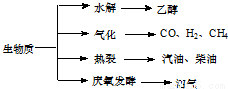
(1)下列有关说法正确的是
A.生物质能,本质上能量来源于太阳能
B.由纤维素水解获得的乙醇属生物质能
C.生物质裂解获得的汽油、柴油等属于纯净物
D.由植物秸秆等发酵获得的沼气,主要成分是甲烷
(2) 由生物质能获得的CO和H2,当两者1: 1催化反应,其原子利用率达100%,合成的物质可能是________。
A.汽油 B.甲醇 C.甲醛(HCHO) D.乙酸
(3) 已知在生物质气化炉中可发生:
C(s)+CO2(g)═2CO(g);△H=+172kJ/mol
CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206kJ/mol
CH4(g)+2H2O(g)═CO2(g)+4H2(g);△H=+165kJ/mol
则C(s)+H2O(g)═CO(g)+H2(g);△H=____________kJ/mol.
(4)由生物质能获得的CO和H2可以用来合成液态燃料甲醇,实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(5) 己知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com