
| A. | 原子半径大小为W<X<Y<Z | |
| B. | W与X、Y、Z分别形成最简单化合物中最稳定的是Z | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
分析 短周期元素W、X、Y和Z的原子序数依次增大.X的一种核素在考古时常用来鉴定一些文物的年代,用的是C14,故X为C元素;工业上采用液态空气分馏方法来生产Y的单质,Y可能是氧气或氮气,又因为Y和Z可以形成化合物ZY2和ZY3,所以Y是氧元素,Z是硫元素;W的原子半径最小,所以W是H元素.
解答 解:短周期元素W、X、Y和Z的原子序数依次增大.X的一种核素在考古时常用来鉴定一些文物的年代,用的是C14,故X为C元素;工业上采用液态空气分馏方法来生产Y的单质,Y可能是氧气或氮气,又因为Y和Z可以形成化合物ZY2和ZY3,所以Y是氧元素,Z是硫元素;W的原子半径最小,所以W是H元素.
A.同周期元素从左到右元素的原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,一般电子层越多原子半径越大,所以四种元素的原子半径大小为:H<O<C<S,即:W<Y<X<Z,故A错误;
B.氢化物稳定性与元素非金属性一致,而氧元素非金属性最强,故氢化物是H2O最稳定,故B错误;
C.W为H元素、Y为O元素,W与Y可形成化合物H2O2,既含极性共价键H-O键,又含非极性共价键O-O键,故C正确;
D.W为H元素,X为C元素,Y为N元素,C元素与H元素可以形成多种烃类化合物,当相对分子质量较大时,形成的烃在常温下为液体或固体,沸点较高,可以高于氧元素与氢元素形成的化合物的沸点,故D错误.
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,注意正确推断元素的种类为解答该题的关键,易错点为D,注意碳氢化合物的种类以及性质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ⑥⑧ | C. | ②⑤ | D. | ③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
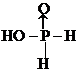 .H3PO2是一元(填“一”、“二”或“三”)酸.
.H3PO2是一元(填“一”、“二”或“三”)酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.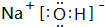 ,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程
,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程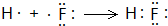 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
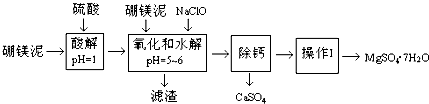
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,说明H2SiO3的酸性大于H2CO3的酸性 | |
| B. | 因为SO2具有漂白性,所以它能使品红溶液、溴水褪色 | |
| C. | 二氧化硅是生产光导纤维、玻璃的基本原料 | |
| D. | CO2、CH4、N2是温室气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:| 元素 | 特 点 |
| A | 其气态氢化物呈三角锥形,水溶液显碱性 |
| B | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
| C | 基态原子占据两种形状的原子轨道,且最外层电子数等于最内层电子数 |
| D | 元素原子的外围电子层排布式为nsn-1npn-1 |
| E | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com