
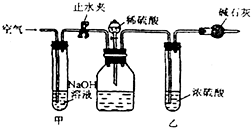
 在室温和大气压强下,用图示的装置进行实验,测得a g含CaC2 90%的样品与水完全反应产生的气体体积为b L.现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题:
在室温和大气压强下,用图示的装置进行实验,测得a g含CaC2 90%的样品与水完全反应产生的气体体积为b L.现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题: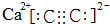
 ;
;| ad |
| bc |
| ad |
| bc |


科目:高中化学 来源: 题型:
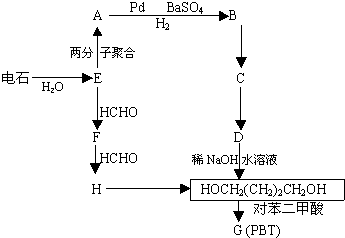
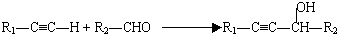 (R代表烃基,下同.)
(R代表烃基,下同.)| Pd,BaSO4 |
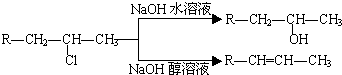
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9~11之间;0.1 |
| B、9~11之间;0.05 |
| C、12~13之间;0.2 |
| D、13;0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
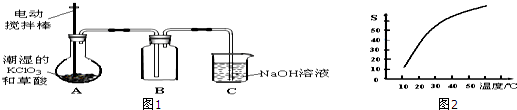
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 |
| B、FeCl3 |
| C、Fe(NO3)3 |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙醚 |
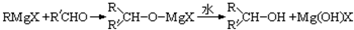 (R,R′可以是相同的烃基,也可能是不同的烃基)现用乙烯和适当的无机物合成乙酸异丁酯
(R,R′可以是相同的烃基,也可能是不同的烃基)现用乙烯和适当的无机物合成乙酸异丁酯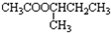 的过程如图(反应条件和部分产物没有列出):
的过程如图(反应条件和部分产物没有列出):
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com