
【题目】饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,__元素的化合价升高,则该元素的原子__(填“得到”或“失去”)电子;而__元素的化合价降低,则该元素的原子被__(填“氧化”或“还原”)。
(2)上述反应中,若有10个铝原子参与反应,则转移的电子总数为__,用“双线桥法”表示反应中电子转移的方向和数目:___
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合液中K+ 、Al3+、 SO42-的浓度分别为0.1mol/L、0.1mol/L、0.2mol/L,则所取三者的体积比是(假定混合后的体积不变)( )
A.1:1:1 B.2:1:2 C.1:1:2 D.2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4与CO2重整生成H2和CO的过程中主要发生下列反应
![]()
![]()
在恒压、反应物起始物质的量比![]() 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是

A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100 mL 14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12 mol
C.得到5.08 g沉淀时,加入NaOH溶液的体积是700 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为
![]()
实验步骤如下:
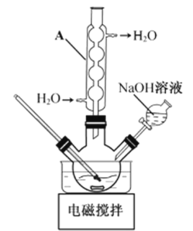
步骤1:如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,如图所示的装置中仪器A的名称是___________;逐步加入NaOH溶液的目的是____________。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是_______________。
(3)步骤3中,粗产品溶解于过量水会导致产率__________(填“增大”或“减小”);去除活性炭的操作名称是_______________。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸钡与盐酸反应2H++BaCO3===Ba2++H2O+CO2↑
B. 氢氧化钡溶液与稀硫酸混合Ba2++![]() +H++OH-===BaSO4↓+H2O
+H++OH-===BaSO4↓+H2O
C. 金属钠与水的反应 Na+H2O===Na++OH-+H2↑
D. 铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)有以下几种物质:①碳酸氢钠晶体 ②液态氯化氢 ③铁 ④蔗糖 ⑤酒精 ⑥熔融的K2SO4 ⑦干冰 ⑧石墨。试回答(填序号):
(1)以上物质能导电的是_________________________。
(2)以上物质中属于非电解质的是_________________________。
(3)以上物质中溶于水后水溶液能导电的是_________________________。
(4)①、②在水溶液中反应的离子方程式为_________________________________。
(二)某溶液的溶质可能由下列离子组成:Cl-、![]() 、
、![]() 、H+、Ba2+、Na+,某同学进行了如下实验:
、H+、Ba2+、Na+,某同学进行了如下实验:
Ⅰ 向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
Ⅱ 向Ⅰ中滤液中加入AgNO3溶液,有白色沉淀产生;
Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
(5)依据以上实验可以推断,原溶液中一定含有____________ (用离子符号表示,下同);一定没有______________;可能含有________________,检验是否存在该离子的方法为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(GaN)是制造LED的重要材料,被誉为“第三代半导体材料”。镓(31Ga)的氧化物和氢氧化物均为两性化合物,工业制备氮化镓的工艺流程如图所示。下列判断正确的是
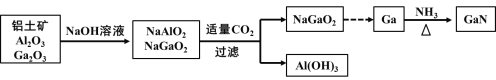
A.Ga位于第五周期第IIIA族B.酸性:Al(OH)3>Ga(OH)3
C.Ga(OH)3可与NaOH反应生成NaGaO2D.Ga与NH3反应的另一种生成物可用作航天燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:
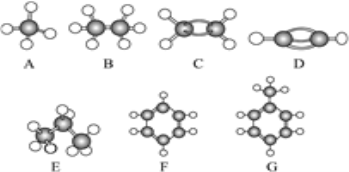
(1)常温下含碳量最高的气态烃是(填对应字母)__;
(2)能够发生加成反应的烃有(填数字)___种;
(3)一卤代物种类最多的是(填对应字母)__;
(4)写出D发生加聚反应的化学方程式:__;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com