

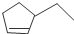

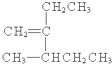
 的结构简式为:CH2=CH(CH3)CH2CH3,其分子式为:C5H10,
的结构简式为:CH2=CH(CH3)CH2CH3,其分子式为:C5H10, 中含有7个C,含有1个环、1个碳碳双键,不饱和度为2,则比庚烷少4个H氢原子,该有机物分子式为:C7H12,
中含有7个C,含有1个环、1个碳碳双键,不饱和度为2,则比庚烷少4个H氢原子,该有机物分子式为:C7H12, :该有机物为烷烃,分子中最长碳链含有6个C,主链为己烷,在3号C含有1个甲基、4号C含有1个乙基,该有机物名称为:3-甲基-4-乙基己烷,
:该有机物为烷烃,分子中最长碳链含有6个C,主链为己烷,在3号C含有1个甲基、4号C含有1个乙基,该有机物名称为:3-甲基-4-乙基己烷, :该有机物为烯烃,含有碳碳双键的最长碳链含有5个C,主链为戊烯,编号从距离碳碳双键最近的一端开始,碳碳双键在1号C,在2号C含有1个乙基,3号C含有1个甲基,该有机物名称为:3-甲基-2-乙基-1-戊烯,
:该有机物为烯烃,含有碳碳双键的最长碳链含有5个C,主链为戊烯,编号从距离碳碳双键最近的一端开始,碳碳双键在1号C,在2号C含有1个乙基,3号C含有1个甲基,该有机物名称为:3-甲基-2-乙基-1-戊烯,

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
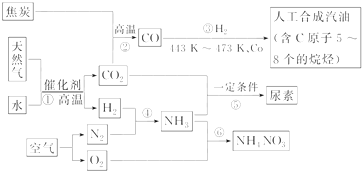
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时甲、乙内压强相等 |
| B、平衡时甲、乙中SO3的物质的量相等 |
| C、甲容器内平衡前后压强比为10:9 |
| D、开始时甲、乙两容器的体积比为9:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 170℃ |
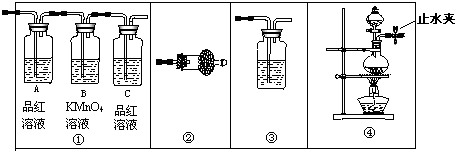
查看答案和解析>>
科目:高中化学 来源: 题型:
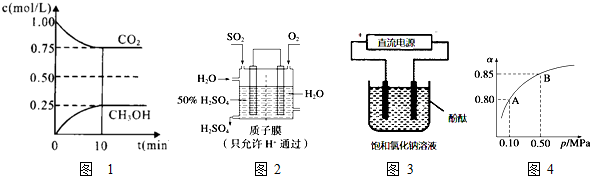
| n(CH3OH) |
| n(CO2) |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| H2SO4 |
| CuO |
| H2SO4 |
| Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com