
����Ŀ��A��B��C��D����ǿ�������Һ�ֱ������������������еĸ�һ���Ҳ��ظ���NH![]() ��Ba2+��H+��Na+��SO42-��CO32-��NO3-��OH��
��Ba2+��H+��Na+��SO42-��CO32-��NO3-��OH��
��֪������A��D�е���C�����г���������
����A��B�зֱ�μ�D���ɼ��ȣ������������ɣ���������������ˮ���ܷ�Ӧ����D�� �Իش��������⣺
��1��д��A��B��C��D������Һ�����ʵĻ�ѧʽ��
A______________��B______________��C______________��D______________��
��2��D��B��Ӧ�������壬�������ܱ�A���գ�д���ù����з�����Ӧ�����ӷ���ʽ__________________________________��_________________________________��
��3����A��D��Ӧ���ɵ����建��ͨ�뺬KOH��Ca(OH)2��NaAlO2�Ļ����Һ�У����ɳ��������ʵ���n��ͨ����������V�Ĺ�ϵ�ɱ�ʾ______________������ĸ����
 ��
��
���𰸡�H2SO4NaOHBa(NO3)2��NH4��2CO3NH4++OH-![]() NH3��+H2ONH3+H+=NH4+C
NH3��+H2ONH3+H+=NH4+C
��������
���⣨1����NH4+��Ba2+��Na+��H+��SO42����NO3����OH����CO32�������п������ɵ�������NH3��CO2���֣���D��A��B��Ӧ���ɣ���D�к���CO32-��NH4+���ӣ�ӦΪ(NH4)2CO3����A��D�е���C�����г������ɣ�˵��A�к���SO42-��C��Ӧ����Ba2+����A��D��Ӧ��������˵��Aһ�������ᣬ�����������Ƕ�����̼���ܱ�B���գ�˵��B��һ�ּ����C�����ᱵ��B���������ƣ�
��2��D��B��Ӧ���ɵ�����ΪNH3����Ӧ�����ӷ���ʽΪNH4++OH-![]() NH3��+H20�����ɵİ�����H2SO4���գ���Ӧ�����ӷ���ʽΪNH3+H+=NH4+��
NH3��+H20�����ɵİ�����H2SO4���գ���Ӧ�����ӷ���ʽΪNH3+H+=NH4+��
��3��ͨ���CO2�Ⱥ�Ca(OH)2��Ӧ����CaCO3���Ӻ�KOH��Ӧ����K2CO3���ٺ�NaAlO2��Ӧ����Al(OH)3�����ź�K2CO3��Ӧ����KHCO3���ٺ�CaCO3��Ӧ����Ca(HCO3)2��


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ч���ٶ���������ŷţ�ʵ�����÷�ú�ң���Ҫ��Al2O3��SiO2�ȣ��Ʊ���ʽ������[Al2(SO4)x(OH)6��2x]��Һ�����������������о���

����˵���������
A. ���������Ҫ�ɷ�ΪSiO2
B. ��CaCO3������Һ��pH��3.6����Ŀ�����к���Һ�е��ᣬ��ʹAl2(SO4)3ת��ΪAl2(SO4)x(OH)6��2x
C. ����pHʱ����Һ��pHƫ�ߣ����ᵼ����Һ����Ԫ�صĺ������ͣ���Ӧ�����ӷ���ʽ���£�3CaCO3+2Al3++3H2O=2Al(OH)3+3Ca2++3CO2��
D. ���������о���ȫ�ȷֽ�ų���SO2������С�����յ�SO2����������Ҫԭ������Һ�еIJ���SO32-��������SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǻ�ѧ����С����Ƶ��û�ѧ��ԴʹLED�Ʒ����װ��ʾ��ͼ�������йظ�װ�õ�˵����ȷ����( )

A. ͭƬΪ�������丽������Һ��������Һ����Cu2������
B. �����пƬ������Ƭ����·�еĵ������ı�
C. ������ת������ʽ��Ҫ������ѧ����������������
D. �����ϡ���ỻ������֭��LED�ƽ����ᷢ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ֧Ӳ�ʴ��Թܣ�ͨ���ű���ʳ��ˮ�ķ����Ⱥ��ռ����Թܼ���Ͱ��Թ�����(��ͼ)�����ж����Թ��ڷ����ķ�Ӧ�������˵����ȷ���ǣ�

A. Ϊ�ӿ컯ѧ��Ӧ���ʣ�Ӧ��ǿ�����������
B. ����� Cl2 ��Ӧ���Թ��ڱڵ���״Һ������� CH3Cl ��CH2Cl2��CHCl3��CCl4
C. ʢ�ű���ʳ��ˮ��ˮ�۵ײ�����������������
D. CH4 �� Cl2 ��ȫ��Ӧ��Һ��������Һ������Թ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧʽΪ![]() ��������˵������ȷ����
��������˵������ȷ����![]() ����
����![]()
A. ������![]() ��
��![]() �������9
�������9
B. ����������![]() ����������
����������![]()
C. �ڽ������е�![]() ����Ŀ����2��1
����Ŀ����2��1
D. ��������![]() ��Һ������
��Һ������![]() ������ȫ����
������ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� A��B��C��D��E ���ֶ���������Ԫ�أ�ԭ�������� A �� E ��������A Ԫ�������������Ǵ����������� 2 ���� ��B �������Ӻ� C ������������ԭ�ӵĵ��Ӳ�ṹ��ͬ������ͨ��״���£�B �ĵ��������壬0.1molB ��������������������ȫ��Ӧ���� 0.4mol ����ת�ƣ���C �ĵ����ڵ�ȼʱ�� B �ĵ��ʳ�ַ�Ӧ�����ɵ���ɫ�Ĺ��壬 �˵���ɫ�������� AB2 ��Ӧ������ B �ĵ��ʣ���D ����̬�⻯��������ۺ�������ܷ���������ԭ��Ӧ����д����
��1��A Ԫ�ص����������ĵ���ʽ_________________��A Ԫ�ؼ���̬�⻯��ɹ��ɼ���ȼ�ϵ�أ��õ�صĵĸ����缫����ʽΪ��_____________________
��2��B Ԫ�������ڱ��е�λ�� _____________________
��3��B ������ C �����ڵ�ȼʱ��Ӧ����������������ѧ�������� _________________
��4��D Ԫ�صĵͼ��������� E �ĵ��ʵ�ˮ��Һ��Ӧ�Ļ�ѧ����ʽΪ ��____________________
��5��C �� D ���γ� 2��1 �Ļ�����õ���ʽ��ʾ�û�������γɹ��̣�_________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��J��Q���ֶ���������Ԫ�أ�ԭ��������������Ԫ��Z�ڵؿ��к�����ߣ�JԪ�ص���ɫ��Ӧ�ʻ�ɫ��Q�����������������������֮��Ϊ3��8��X����J�γ����ӻ������J���İ뾶����X���İ뾶��Y�����������γ��������Ҫ����֮һ����ش�
(1)QԪ�������ڱ��е�λ��Ϊ________________��
(2)��������Ԫ��ԭ�Ӱ뾶�Ӵ�С���У����ڵ�����Ԫ��ԭ����______________(��Ԫ�ط���)��
(3)Ԫ�صķǽ�����Z________Q(�>����<��)�����и����У�����˵����һ���۵���ʵ��________(�����)��
A��Q���⻯���ˮ��Һ�����ڿ����л�����B��Z��Q֮���γɵĻ�������Ԫ�صĻ��ϼ�
C��Z��Q�ĵ��ʵ�״̬ D��Z��Q�����ڱ��е�λ��
(4)X��Y���γɷ���A��Ҳ���γ�������B��A��B��ˮ��Һ���ᡢ����ǡ���෴��д�������ӣµ����幹��Ϊ__________�������м���Ϊ_________��X��Q��һ�������¿����γɼ����ȶ���ԭ�Ӹ�����Ϊ1:1�Ļ�����û���������м��м��Լ����зǼ��Լ���д���÷��ӵĽṹʽ________________��
(5)M��N��Ϊ��������Ԫ���е�������ɵĻ������M��N��Ϊǿ����ʣ�M��N����Һ��Ӧ���г��������������������д��M��N��Ӧ�Ļ�ѧ����ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪a��b��c��d���ֶ���������Ԫ�أ������ڱ������λ����ͼ������˵����ȷ����
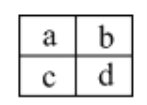
A. a��c��Ԫ�ص��������һ�����
B. ԭ�Ӱ뾶��С˳��Ϊ��c>d>b>a
C. a��b��Ԫ�ؿ����γɶ��ֹ��ۻ�����
D. c��d����Ԫ����̬�⻯����ȶ��ԱȽϣ�c > d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ���ҳ���MnO2��Ũ���ᷴӦ�Ʊ�Cl2(MnO2+4HCl(Ũ)��MnCl2+Cl2��+2H2O��Ӧװ����ͼ��ʾ)��
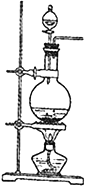
��1��װ��ͼ�е���Ҫ���������оƾ��ơ�________��__________�ȡ�����������ͨ��ˮ���Ƶ���ˮ���á���ˮ���е����ӳ�H+��Cl-���___________�����ӣ���ˮ������__________������Ư���ԡ�
��ij�Ȼ�����Ʒ��������FeCl2���ʡ���Ҫ�ⶨ������Ԫ�ص�����������ʵ�鰴���²�����У�
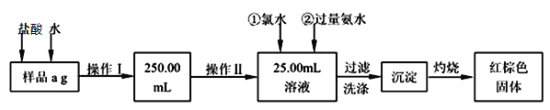
������������̣��ش��������⣺
��2����Ʒ�ܽ�ʱ�������������___________________________________��������ˮ��������Ӧ�����ӷ���ʽ___________________________________��
��3��֤��Fe3+�����Ѿ�������ȫ�IJ�����___________________________________����������������չ����У�Ϊʹʵ����ȷ������IJ���Ϊ___________________��
��4����ԭ��Ʒ����a Ϊ40.00g�����Ⱥ����ɫ��������bΪ2.200g������Ʒ����Ԫ�ص�����������_________��������ȷ�����ղ����Ľ��ƫ�����������ԭ�������_____________(д��һ��ԭ��)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com