
 按以下步骤从
按以下步骤从 合成
合成  .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去) 、D
、D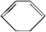 .
.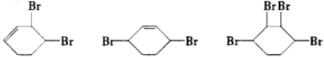 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O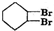 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O. 分析 苯酚与氢气发加成反应生成A为 ,A发生消去反应生成B为
,A发生消去反应生成B为 ,环己烯与溴发生加成反应生成C为
,环己烯与溴发生加成反应生成C为 ,从C经过系列转化得到
,从C经过系列转化得到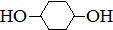 ,官能团有-Br转化为-OH且由邻位转化为对位,故C发生消去反应生成D为
,官能团有-Br转化为-OH且由邻位转化为对位,故C发生消去反应生成D为 ,D与溴发生1,4-加成反应生成E为
,D与溴发生1,4-加成反应生成E为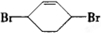 ,E与氢气发生加成反应生成F为
,E与氢气发生加成反应生成F为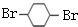 ,F发生水解反应生成
,F发生水解反应生成 ,据此解答.
,据此解答.
解答 解:苯酚与氢气发加成反应生成A为 ,A发生消去反应生成B为
,A发生消去反应生成B为 ,环己烯与溴发生加成反应生成C为
,环己烯与溴发生加成反应生成C为 ,从C经过系列转化得到
,从C经过系列转化得到 ,官能团有-Br转化为-OH且由邻位转化为对位,故C发生消去反应生成D为
,官能团有-Br转化为-OH且由邻位转化为对位,故C发生消去反应生成D为 ,D与溴发生1,4-加成反应生成E为
,D与溴发生1,4-加成反应生成E为 ,E与氢气发生加成反应生成F为
,E与氢气发生加成反应生成F为 ,F发生水解反应生成
,F发生水解反应生成 .
.
(1)由上述分析可知,B的结构简式为 ,D的结构简式为
,D的结构简式为 ,
,
故答案为: ;
; ;
;
(2)反应①~⑦中,①为加成反应,②为消去反应,③加成反应,④为消去反应,⑤为加成反应,⑥为加成反应,⑦为取代反应,故答案为:②④;
(3)如果不考虑⑥、⑦反应,对于反应⑤, 可与溴发生1,2-加成,1,4-加成或完全加成,得到的E可能的结构简式为
可与溴发生1,2-加成,1,4-加成或完全加成,得到的E可能的结构简式为 ,
,
故答案为: ;
;
(4)A→B的反应方程式为: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,
+H2O,
C→D的反应方程式为: +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O,
+2NaBr+2H2O,
故答案为: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O; +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.
点评 本题考查有机物的推断与合成,题目难度不大,根据反应条件及物质的结构进行推断,需要学生熟练掌握官能团的性质与转化,有利于基础知识的巩固.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N元素的电负性较大,但N2的化学性质很稳定 | |
| B. | 稀有气体一般难发生反应 | |
| C. | HF比H2O稳定 | |
| D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. |  能与Na2CO3溶液反应生成CO2 能与Na2CO3溶液反应生成CO2 | B. |  与BHT互为同系物 与BHT互为同系物 | ||
| C. | BHT久置于空气中不会被氧化 | D. | 两种方法的反应类型都是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定反应速率的因素只有催化剂 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 锌与稀硫酸反应时,加入少量水能加快产生氢气的速率 | |
| D. | 增大压强一定能使化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃101 kPa时,2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1此反应的反应热为221 kJ•mol-1 | |
| B. | 氢气的燃烧热为285.8 kJ•mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |
| C. | 已知2SO2(g)+O2(g)═2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 | |
| D. | 稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1稀硝酸与稀Ba(OH)2溶液反应的中和热为57.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
| A. | 已知t1>t2,HX的生成反应为放热反应 | |
| B. | 在相同条件下,X2平衡转化率a:F2>Cl2 | |
| C. | X2与H2反应的剧烈程度随着原子序数递增逐渐减弱 | |
| D. | HX的稳定性:HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
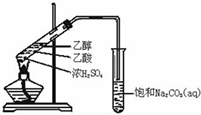 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.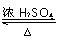 CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com