
【题目】钠硝石又名智利硝石,主要成分为NaNO3。据最新勘探预测表明,我国吐鲁番盆地钠硝石资源量约2.2亿吨,超过了原世界排名第一的智利。一种以钠硝石为原料制备KNO3的流程如下图所示(矿石中其他物质均忽略):

相关化合物溶解度随温度变化曲线如下图所示:

回答下列问题:
(1) NaNO3是________________(填“电解质”或“非电解质”)。
(2) 一定温度下,NaNO3可分解生成Na2O、NO和O2,该反应的化学方程式为__________________。
(3) 为提高钠硝石的溶浸速率,可对矿石进行何种预处理________________(答出一种即可)。
(4) 为减少KNO3的损失,步骤a的操作应为:________________________________;
步骤b中控制温度可为下列选项中的________。
A.10℃ B.40℃ C.60℃ D.90℃
(5) 如何验证洗涤后的KNO3中没有Cl-:_______________________________________。
(6) 若100吨钠硝石可生产60.6吨KNO3,则KNO3的产率为________。
【答案】 电解质 4NaNO3![]() 2Na2O+4NO↑+3O2↑ 粉碎 蒸发结晶,趁热过滤 A 取最后一次洗涤的洗涤液少许于试管中,滴加HNO3酸化的AgNO3溶液,若未出现白色沉淀,说明洗涤后的KNO3中没有Cl- 51%
2Na2O+4NO↑+3O2↑ 粉碎 蒸发结晶,趁热过滤 A 取最后一次洗涤的洗涤液少许于试管中,滴加HNO3酸化的AgNO3溶液,若未出现白色沉淀,说明洗涤后的KNO3中没有Cl- 51%
【解析】 (1)根据NaNO3是易溶于水的盐判断;
(2) 根据NaNO3可分解生成Na2O、NO和O2书写反应的化学方程式并配平;
(3) 根据影响化学反应速率的因素分析;
(4) 根据相关化合物溶解度随温度变化曲线可知,硝酸钾的溶解度随温度的变化明显,而氯化钠的溶解度随温度的变化不大分析解答;步骤b中需要析出硝酸钾晶体,从尽可能多的析出硝酸钾考虑;
(5)检验有没有Cl-;
(6) 根据硝酸根守恒,存在NaNO3~ KNO3,首先计算理论上100吨钠硝石可生产KNO3的质量,再求KNO3的产率。
(1) NaNO3是易溶于水的盐,属于电解质,故答案为:电解质;
(2) 一定温度下,NaNO3可分解生成Na2O、NO和O2,该反应的化学方程式为4NaNO3![]() 2Na2O+4NO↑+3O2↑,故答案为:4NaNO3
2Na2O+4NO↑+3O2↑,故答案为:4NaNO3![]() 2Na2O+4NO↑+3O2↑;
2Na2O+4NO↑+3O2↑;
(3) 根据影响化学反应速率的因素可知,可将矿石粉碎,以提高钠硝石的溶浸速率,故答案为:粉碎;
(4) 根据相关化合物溶解度随温度变化曲线可知,硝酸钾的溶解度随温度的变化明显,而氯化钠的溶解度随温度的变化不大,为减少KNO3的损失,步骤a应为蒸发结晶,趁热过滤;步骤b中需要析出硝酸钾晶体,为了尽可能多的析出硝酸钾,应该控制温度在10℃最好,故答案为:蒸发结晶,趁热过滤;A;
(5) 要验证洗涤后的KNO3中没有Cl-,只需要取最后一次洗涤的洗涤液少许于试管中,滴加HNO3酸化的AgNO3溶液,若未出现白色沉淀,即可说明洗涤后的KNO3中没有Cl-,故答案为:取最后一次洗涤的洗涤液少许于试管中,滴加HNO3酸化的AgNO3溶液,若未出现白色沉淀,说明洗涤后的KNO3中没有Cl-;
(6) 根据硝酸根守恒,存在NaNO3~ KNO3,理论上100吨钠硝石可生产KNO3的质量为100吨×![]() =118.8吨,则KNO3的产率为
=118.8吨,则KNO3的产率为![]() ×100%=51%,故答案为:51%。
×100%=51%,故答案为:51%。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】 对此聚合物分析正确的是( )
对此聚合物分析正确的是( )
A. 其单体是CH2=CH2和HCOOC2H5
B. 它是缩聚反应产物
C. 其单体是CH2=CH-COOC2H5
D. 其链节是CH3CH2-COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。 某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素分别转化为氢氧化物沉淀而分离开来。
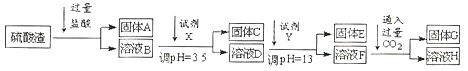
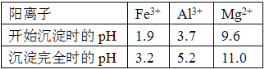
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)工业上用固体A作原料制取水玻璃的化学方程式为_________。
(2)固体E的化学式为_________。
(3)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_______。
(4)上述流程中的试剂Y最好选用下列中的_______(选填字母编号)。
A.水 B.硫酸 C.氨水 D.氢氧化钠
(5)写出反应F→H的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知

A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g质量分数为46%的乙醇水溶液中含有氧原子数为4NA
B. 若将1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C. 向大量水中通入1 mol氯气,反应中转移的电子数为NA
D. 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室常用的几种气体发生装置如图A、B、C所示:
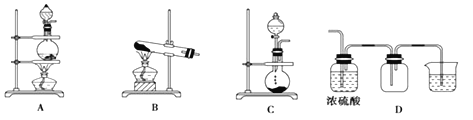
回答下列问题:
①若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的_____。
A.CO2 B.H2 C.Cl2 D.NH3
②D装置的小烧杯中应盛放NaOH溶液,目的是__________________。
③若要收集干净纯净的X气体,上述装置应如何改进____________________。
④若用B装置制取氨气可以用_________(填试剂名称)进行干燥。
(2)某化学兴趣小组为探究SO2的性质,按下图所示装置进行试验。

请回答下列问题:
①装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_________、________。
②反应后,装置B中发生的现象是____________,装置D表现了SO2的_____性,装置E表现了SO2的______性。
③F装置漏斗的作用是_____________。
④装置C中发生的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL溴化亚铁溶液中通入2.24L氯气(标准状况),若有三分之一的溴离子被氧化,则原溴化亚铁溶液的物质的量浓度为( )
A. 3mol/L B. 1. 2mol/L
C. 1. 5mol/L D. 2.0mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com