
有机物G是制备液晶材料的中间体之一,其结构简式为:

其中,A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:X的核磁共振氢谱只有1种峰;RCH=CH2 RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
(1)A的结构简式是 ;C中官能团的名称是 。
(2)B的名称是 。第①~⑦步中属于取代反应的有 (填步骤编号)。
(3)写出反应⑤的化学方程式: 。
(4)第⑦步反应的化学方程式是 。
(5)G经催化氧化得到Y(C11H12O4),写出同时满足下列条件的Y的所有同分异构体的结构简式 。
a.苯环上的一氯代物有2种;b.水解生成二元羧酸和醇。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【化学—选修5:有机化学基础】(15分)I.施安卡因(G)是一种抗心律失常药物,可由下列路线合成。

(1)已知A是 的单体,则A中所含官能团的名称是______ 。
的单体,则A中所含官能团的名称是______ 。
(2)B的结构简式为______;用系统命名法给C命各为______。
(3)C与足量NaOH醇溶液共热时反应的化学方程式为______。F→G的反应类型为______。
(4)L是E的同分异构体,分子中含有苯环且苯环上一氯代物只有两种,则L所有可能的结构简式有 、_______、_______、_______。
、_______、_______、_______。
Ⅱ.H是C的同系物,其核磁共振氢谱有两个峰。按如下路线,由H可合成高聚物V

(5)H的结构简式为______。
(6)Q→V反应的化学方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备乙酸丁酯,反应温度要控制在115℃~125℃之间,其他有关数据如下表:
| 物质 | 乙酸 | 1−丁醇 | 乙酸丁酯 | 98%浓硫酸 |
| 沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
| 溶解性 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 微溶于水,溶于有机溶剂 | 与水混溶 |
关于实验室制备乙酸丁酯的叙述错误的是
A.不能边反应边蒸出乙酸丁酯的原因:乙酸丁酯的沸点高
B.不用水浴加热是因为:乙酸丁酯的沸点高于100℃
C.从反应后混合物分离出粗品的方法:用Na2CO3溶液洗涤后分液
D.由粗品制精品需要进行的一步操作:加吸水剂蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
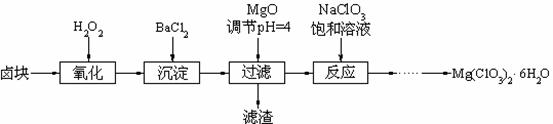
已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、
FeCl2等杂质。
 ②几种化合物的溶解度(S)随温度(T)变化曲线
②几种化合物的溶解度(S)随温度(T)变化曲线
如右图。
40.加MgO后过滤所得滤渣的主要成分为 。
41.加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全? 。
42.加入NaClO3饱和溶液会发生如下反应:
MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,
请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应,② ;③ ;④ ;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
43.上述产品测定中需要检查是否漏液的仪器有 。
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏 。(填“大”或“小”)。
44.产品中Mg(ClO3) 2·6H2O的质量分数为 。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实所对应的方程式不正确的是
A.盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2 + 2NaOH === Na2SiO3 + H2O
B.高温下铁与水蒸气反应生成保护膜:2Fe + 6H2O(g)  2Fe (OH)3 + 3H2
2Fe (OH)3 + 3H2
|
D.实验室制取氨气:2NH4Cl + Ca(OH)2 === CaCl2 + 2NH3↑+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质有许多相似之处。已知锡元素具有如下性质:
 ;
;




 。
。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:_____________________________________________________,_______________________________________。
②将①中溶液蒸干后继续灼烧所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是__________(填化学式)。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱可选用________。
(2)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
|
| 阳离子 |
|
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示。

①若Y是盐酸,则溶液中含有的金属阳离子是_________,ab段发生反应的离子方程式为_______________,图中oa段参加反应的阴离子的物质的量之比为___________________。
②若Y是NaOH溶液,则bc段反应的离子方程式为____________________。
若不考虑离子的水解,忽略H+和OH-的影响,且溶液中只存在四种离子,则它们的离子个数比为_____________________________________________(按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com