
| A. | 1.5 mol | B. | 3 mol | C. | 5 mol | D. | 6 mol |
科目:高中化学 来源: 题型:推断题
 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含3.01×1023个氮原子的N2 | B. | 标准状况下11.2 L H2 | ||
| C. | 1 mol Na2SO4中的Na+ | D. | 常温常压下32 g O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.
某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 矿泉水中不含任何化学物质 | |
| B. | 聚乙烯塑料薄膜可用作食品包装袋 | |
| C. | 碳酸钡可用作医疗上的“钡餐” | |
| D. | 氢氧化钠可用作治疗胃酸过多的药物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
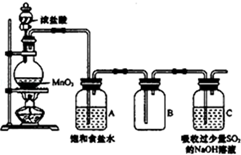 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2:向A试管中滴加1-2滴0.01mol/LKMnO4溶液 | Ⅰ:若溶液紫红色褪去,则假设1成立; Ⅱ:若溶液紫红色不褪去,则假设2或3成立, |
| 步骤3:向B试管中滴加1-2滴淀粉KI溶液 | Ⅰ:若溶液变蓝色,则假设1成立; Ⅱ:若溶液不变蓝色,结合步骤2中的II,假设3成立, |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com