
分析 试管中O2和NO2气体按体积比1:4混合全部溶解,液体充满试管,题中充分反应后,试管中液面高度为试管高度的$\frac{1}{2}$,说明剩余气体为$\frac{1}{2}$,可能是剩余氧气,也可以是剩余的二氧化氮气体与水反应生成的一氧化氮剩余,所以设O2体积为设混合气体总体积为5L,则如果剩余氧气时,O2和NO2按照1:4反应的混合气体为$\frac{1}{2}$;如果剩余一氧化氮,按照O2和NO2气体按体积比1:4混合全部溶解,实际剩余二氧化氮为$\frac{3}{2}$,不可能,说明剩余的气体为氧气;
试管中液面高度为试管高度的$\frac{5}{6}$,说明剩余气体为 $\frac{1}{6}$,可能是剩余氧气,也可以是剩余的二氧化氮气体与水反应生成的一氧化氮剩余,设混合气体总体积为6L,如果剩余氧气时,O2和NO2按照1:4反应的混合气体为 $\frac{5}{6}$;如果剩余一氧化氮,按照O2和NO2气体按体积比1:4混合全部溶解,实际剩余二氧化氮 $\frac{1}{2}$,即可求出所有二氧化氮和氧气的体积,进而求的原混合气体中O2和NO2的体积比.
解答 解:①已知二氧化氮气体和氧气按4:1恰好全部溶于水生成硝酸,发生的反应为:4NO2+O2+2H2O=4HNO3,题中试管倒扣水槽中最后试管中液面高度为试管高度的$\frac{1}{2}$,说明剩余气体为$\frac{1}{2}$,
当剩余气体为氧气时,二氧化氮气体和氧气按4:1反应的混合气体体积为$\frac{1}{2}$,其中二氧化氮为$\frac{2}{5}$,氧气$\frac{1}{10}$,所以原混合气体中氧气共$\frac{1}{2}$+$\frac{1}{10}$=$\frac{3}{5}$,原混合气体中O2和NO2的体积比为$\frac{2}{5}$:$\frac{3}{5}$=2:3;
如果剩余气体$\frac{1}{2}$为一氧化氮,根据反应3NO2+H2O=2HNO3+NO,则相当于剩余二氧化氮为$\frac{3}{2}$>1,则剩余气体不可能为NO;
②试管倒扣水槽中最后试管中液面高度为试管高度的 $\frac{5}{6}$,说明剩余气体为 $\frac{1}{6}$,
当剩余气体为氧气时,二氧化氮气体和氧气按4:1反应的混合气体体积为$\frac{5}{6}$,其中二氧化氮为$\frac{2}{3}$,氧气 $\frac{1}{6}$,所以原混合气体中氧气共:$\frac{1}{6}$+$\frac{1}{6}$=$\frac{1}{3}$,原混合气体中O2和NO2的体积比为:$\frac{1}{3}$:$\frac{2}{3}$=1:2;
如果剩余气体$\frac{1}{6}$为一氧化氮,根据反应3NO2+H2O=2HNO3+NO,则相当于剩余二氧化氮 $\frac{1}{2}$,二氧化氮气体和氧气按4:1反应的混合气体体积为 $\frac{1}{2}$,其中二氧化氮体积应为 $\frac{1}{2}$×$\frac{4}{5}$=$\frac{2}{5}$,原混合气体中共有二氧化氮体积为 $\frac{2}{5}$+$\frac{1}{2}$=$\frac{9}{10}$,氧气体积为 $\frac{1}{2}$×$\frac{1}{5}$=$\frac{1}{10}$,则原混合气体中O2和NO2的体积比为 $\frac{1}{10}$:$\frac{9}{10}$=1:9,
故答案为:n(O2):n(NO2)=2:3;n(O2):n(NO2)=1:2或1:9.
点评 本题考查了混合物的反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰毒、麻黄碱 | B. | 海洛因、青霉素 | C. | 冰毒、海洛因 | D. | 黄曲霉素、尼古丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氮化铝中氮元素的化合价为-3 | |
| B. | 上述反应中每生成2molAlN,N2得到3mol电子 | |
| C. | 在氮化铝的合成反应中,N2是氧化剂,Al2O3是还原剂 | |
| D. | 该反应不属于四种基本反应类型中任一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量镁粉的Fe2(SO)3溶液 | |
| B. | FeCl2溶液与稀硝酸混合后的溶液 | |
| C. | 铁丝在足量的氯气中燃烧后所得产物的溶液 | |
| D. | 长期暴露在空气中的绿矾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
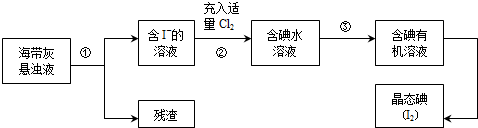
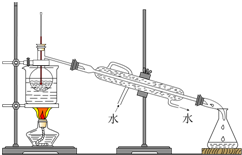
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4、K、HCl | B. | Cl2、Al、H2 | C. | NO2、Na、Br2 | D. | O2、SO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中由水电离出的c(OH-)═10-8 mol•L-1 | |
| B. | c(Na+)═c(X-)+c(HX)=0.1mol•L-1 | |
| C. | c(Na+)-c(X-)═9.9×10-7mol•L-1 | |
| D. | c(OH-)-c(HX)═c(H+)=1×10-8mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com