
【题目】(1)铅蓄电池是典型的可充型电池,请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将_______(填变小、变大或不变);当外电路通过0.5 mol电子时,理论上负极板的质量增加__________g。
(2)用甲醇燃料电池电解AgNO3溶液,如图所示,回答下列问题:
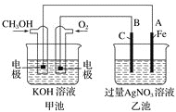
①甲池是________装置;通入CH3OH的电极名称是______,
②写出通入O2的电极的电极反应式是________________。
③A电极的电极反应式为_________________________。
④当乙池中A(Fe)极的质量增加2.70 g时,甲池中理论上消耗O2_____mL(标准状况下)
【答案】PbO2+2e-+4H++ SO42-= PbSO4+ 2H2O 小 24 原电池 负极 O2+2H2O+4e-=4OH- Ag++e-=Ag↓ 140
【解析】
(1)电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O,负极电极反应式为:Pb-2e- +SO42-=PbSO4,正极电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,据此分析判断;
2PbSO4+2H2O,负极电极反应式为:Pb-2e- +SO42-=PbSO4,正极电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,据此分析判断;
(2)①甲池是甲醇燃料电池,则甲池是原电池,乙池为电解池;燃料电池中通入燃料的一极为负极,通入氧气的一极为正极;
②通入O2的电极为正极,电解质为碱性环境;
③乙池为电解池,电极A与原电池负极相连,为阴极,则该电极上为Ag+得电子生成Ag单质;
④乙池中A(Fe)极是阴极,阴极的质量增加2.70 g,增加的是银的质量,先计算银的物质的量,再根据转移电子守恒可得关系式4Ag~O2,进而计算甲池中理论上消耗O2的物质的量。
(1)电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O,负极电极反应式为:Pb-2e- +SO42-=PbSO4,正极电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;放电时,电解液中H2SO4的浓度将减少;当外电路通过0.5mol电子时,依据电子守恒计算理论上负极板的质量增加0.25mol×303g/mol-0.25mol×207g/mol=24g;
2PbSO4+2H2O,负极电极反应式为:Pb-2e- +SO42-=PbSO4,正极电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;放电时,电解液中H2SO4的浓度将减少;当外电路通过0.5mol电子时,依据电子守恒计算理论上负极板的质量增加0.25mol×303g/mol-0.25mol×207g/mol=24g;
故答案为:PbO2+2e-+4H++ SO42-= PbSO4+ 2H2O;小;24;
(2)①甲池是甲醇燃料电池,则甲池是原电池,乙池为电解池;燃料电池中通入燃料的一极为负极,通入氧气的一极为正极,故通入CH3OH的电极名称是负极;
故答案为:原电池;负极;
②通入O2的电极为正极,电解质为碱性环境,则电极反应式是O2+2H2O+4e-=4OH-;
故答案为:O2+2H2O+4e-=4OH-;
③乙池为电解池,电极A与原电池负极相连,为阴极,则该电极上为Ag+得电子生成Ag单质,电极反应式为Ag++e-=Ag↓;
故答案为:Ag++e-=Ag↓;
④乙池中A(Fe)极是阴极,阴极的质量增加2.70 g,增加的是银的质量,其物质的量为![]() ,根据转移电子守恒可得关系式4Ag~O2,所以V(O2)=nVm=
,根据转移电子守恒可得关系式4Ag~O2,所以V(O2)=nVm=![]() ;
;
故答案为:140。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )

A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是




(a)碱性锌锰电池 (b)铅-硫酸蓄电池 (c)电解精炼铜 (d)银锌纽扣电池
A. 图(a)所示电池中,MnO2的作用是催化剂
B. 图(b)所示电池放电过程中,硫酸浓度不断增大
C. 图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因__________________(用离子方程式和相应的文字叙述)。
②在NaHA水溶液中各离子浓度的大小关系是_______________________________
(2)实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的_____(填写物质的名称)。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________(填化学式)。
(3)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4。溶液中c(![]() )从大到小顺序为__________________(填序号)。
)从大到小顺序为__________________(填序号)。
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液等体积混合,则混合液的pH=_________。
(5)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
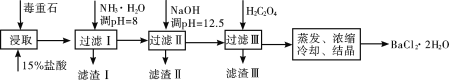
已知:
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
加入NH3·H2O调pH=8可除去______(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g)![]() N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
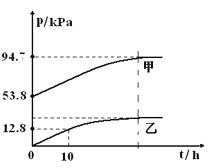
①上图中表示O2压强变化的曲线是_________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率υ=0.12pN2O5(kPah-1),t=10h时,pN2O5=___kPa,υ=_________kPah-1(结果保留两位小数,下同)。
③该温度下2NO2![]() N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO2 ![]() N2O4 △H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )
N2O4 △H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )
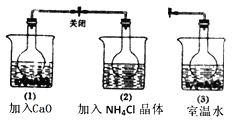
A.(1)中红棕色变深,(2)中红棕色变浅
B.(1)中红棕色变浅,(2)中红棕色变深
C.烧瓶(1)中气体的压强不变
D.烧瓶(2)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y
Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 出现浑浊
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 沉淀变为黑色
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 沉淀逐渐溶解
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为_______________;
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3﹣,还含有的离子有_______________;
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为____________.沉淀转化的主要原因是_____________;
(4)已知:Ag++2NH3H2O===Ag(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)![]() Cu2+(aq)+2Ag(s)设计的原电池如图所示。
Cu2+(aq)+2Ag(s)设计的原电池如图所示。
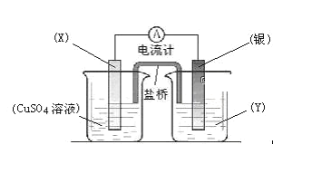
请回答下列问题:
(1)电极X的材料是_______;电解质溶液Y是____________;
(2)银电极为电池的___极,发生的电极反应为_____________;X电极上发生的电极反应为___________;
(3)外电路中的电子是从_______电极流向___________电极;
(4)如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,则

①a电极反应式为_________________________________;
②乙中的总反应为__________________________________;
③若整个电路中有2NA 个电子转移,则d电极产生__________L气体 (标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com