
| A、0.5 mol Fe2+与含0.5 mol H2O2溶液反应,转移NA个电子(NA表示阿伏加德罗常数) | ||
B、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
| ||
| C、复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是2 Fe3++3SO42-+3Ba2++6 OH-=3BaSO4↓+2Fe(OH)3↓ | ||
| D、向2mL 0.1mol/L的硝酸银溶液中滴加几滴0.1mol/L氯化钠溶液,产生白色沉淀,再滴加几滴硫化钠溶液,产生黑色沉淀,说明氯化银能转化为更难溶的硫化银 |
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |


科目:高中化学 来源: 题型:
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用酒精萃取溴水中的溴 |
B、 将硫酸铜溶液直接蒸干得到胆矾 |
C、 说明2NO2(g)?N2O4(g)△H<0 |
D、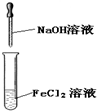 实验室制备Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
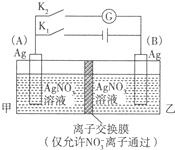 利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )
利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )| A、闭合K1,断开K2后,A电极增重 |
| B、闭合K1,断开K2后,乙池溶液浓度上升 |
| C、断开K1,闭合K2后,NO3-向B电极移动 |
| D、断开K1,闭合K2后,A电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、HCO3-、SO42- |
| B、H+、Fe2+、ClO-、Cl- |
| C、Na+、Ag+、Cl-、SO42- |
| D、K+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、将溶液稀释,
| ||
| B、滴入含0.1 mol CH3COOH的溶液:c(CH3COO-)<c(HCO3-) | ||
| C、通入0.1 mol CO2气体,溶液中存在:c(Na+)=c(CO32-)十c(HCO3-)+c(H2CO3) | ||
| D、滴入酚酞,微热,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ | ||
|
| Fe2+ | ||
|
| OH- | ||
|
| A、在第①反应平衡体系中加入水,溶液中c(H+)增大 |
| B、溶液的pH值不变时,说明第①步反应达平衡状态 |
| C、第②步中,还原0.01mol Cr2O72-离子,需要0.06mol的FeSO4?7H2O |
| D、上述三步转化反应中,只有一个反应为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
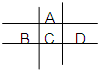 图为周期表的一小部分,A、B、C、D的位置关系如图所示.且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:
图为周期表的一小部分,A、B、C、D的位置关系如图所示.且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com