
在实验室中,用锌、氧化铜、稀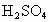 为原料制取铜,有下列两种途径:①
为原料制取铜,有下列两种途径:①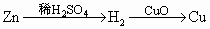
②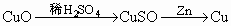
若用这两种方法制取铜的质量相等时,下列符合实验结果的是
[ ]
A.消耗相同质量的CuO
B.消耗相同质量的Zn
C.消耗相同质量的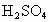
D.生成硫酸锌的质量可能不同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO等,部分生产工艺流程图示意如下:
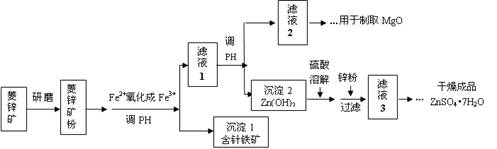
(1)将菱锌矿研磨成粉的目的是 。
(2)工业流程中必须将Fe2+氧化成Fe3+后再加以分离。在实验室中可以用H2O2,在酸性条件下完成这个转化,请写出相应的离子方程式:
。
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是 。
(4)工业上从“滤液2”制取MgO过程中,合适的反应物是 (选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(5)“滤液3”之后的操作依次为 、 、过滤,洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO等,部分生产工艺流程图示意如下:
(1)将菱锌矿研磨成粉的目的是 。
(2)工业流程中必须将Fe2+氧化成Fe3+后再加以分离。在实验室中可以用H2O2,在酸性条件下完成这个转化,请写出相应的离子方程式:
。
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是 。
(4)工业上从“滤液2”制取MgO过程中,合适的反应物是 (选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(5)“滤液3”之后的操作依次为 、 、过滤,洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源:2011届福建师大附中高三上学期期中考试化学卷 题型:填空题
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO等,部分生产工艺流程图示意如下: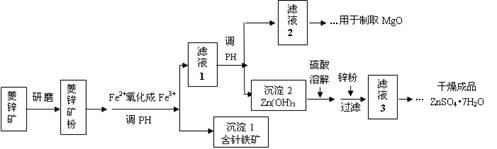
(1)将菱锌矿研磨成粉的目的是 。
(2)工业流程中必须将Fe2+氧化成Fe3+后再加以分离。在实验室中可以用H2O2,在酸性条件下完成这个转化,请写出相应的离子方程式:
。
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是 。
(4)工业上从“滤液2”制取MgO过程中,合适的反应物是 (选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(5)“滤液3”之后的操作依次为 、 、过滤,洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建师大附中高三上学期期中考试化学卷 题型:填空题
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO等,部分生产工艺流程图示意如下:
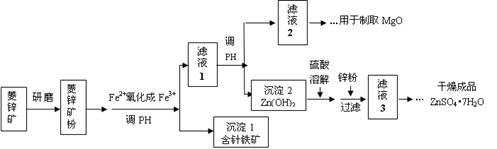
(1)将菱锌矿研磨成粉的目的是 。
(2)工业流程中必须将Fe2+氧化成Fe3+后再加以分离。在实验室中可以用H2O2,在酸性条件下完成这个转化,请写出相应的离子方程式:
。
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是 。
(4)工业上从“滤液2”制取MgO过程中,合适的反应物是 (选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(5)“滤液3”之后的操作依次为 、 、过滤,洗涤,干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com