
| A. | 工业上常采用电解法冶炼Y 单质 | |
| B. | 气态氢化物的稳定性:H2W强于H2Z | |
| C. | 离子半径由大到小:W2->X+>Y3+>Z2-? | |
| D. | W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
分析 原子序数依次递增的4种短周期元素可形成简单离子 W2-,X+,Y3+,Z2-,则W、Z为第VIA,原子序数W小于Z,则W为O元素,Z为S元素,X化合价为+1价为第IA族的Na元素,Y为第IIIA族,原子序数大于Na,则Y为Al元素,结合元素化合物的性质分析.
解答 解:A.Y为Al元素,常用电解熔融的氧化铝的方法制备铝,故A正确;
B.元素的非金属性越强,其氢化物越稳定,非金属性:O大于S,则气态氢化物的稳定性:H2O强于H2S,故B正确;
C.电子层数越多离子半径越大,电子排布相同的离子,原子序数越大,离子半径越小,所以S2->O2->Na+>Al3+?,则Z2->W2-X+>Y3+?,故C错误;
D.W、X 形成的化合物为Na2O或Na2O2,阴、阳离子个数比一定是1:2,故D正确.
故选C.
点评 本题考查元素推断、元素周期律、元素化合物性质等,难度中等,推断元素是解题的关键,需要学生熟练掌握元素化合物性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
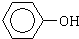 ②CH2=CH2③CH≡CH ④
②CH2=CH2③CH≡CH ④ ⑤
⑤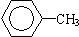 ⑥
⑥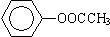 ⑦CH3CH2CH2CH2Br
⑦CH3CH2CH2CH2Br查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对应气态氢化物的稳定性M>R | B. | R元素的最高正价一定为+7价 | ||
| C. | 离子半径:M2->R->N2+ | D. | 还原性:M2-<R- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
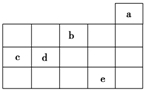 如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,
如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,| A. | b元素除0价外,只有一种化合价 | |
| B. | a元素形成的单质最稳定,分子式为a3 | |
| C. | c、d元素的原子半径:c<d | |
| D. | e元素在自然界中主要存在于海水中,被称为“海洋元素” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
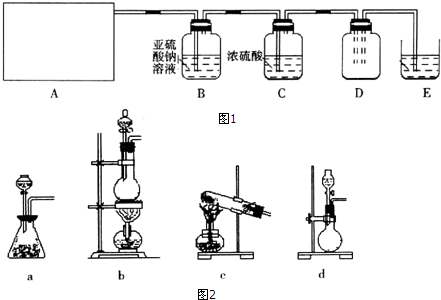
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量B中溶液于试管Ⅰ中,滴加过量稀盐酸和BaCl2溶液 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42- |
| 步骤2:另取适量B中溶液于试管Ⅱ中,滴加过量Ba(NO3)2溶液,振荡,静置 | 产生白色沉淀 |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加稀HNO3和AgNO3溶液. | 若产生白色沉淀,则洗气瓶白溶液中存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
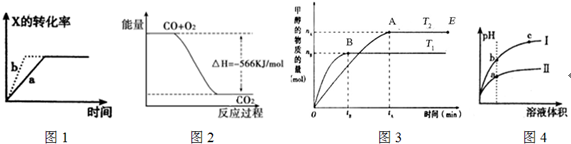
| A. | 图1所示,反应X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | 图2表示CO生成CO2的反应过程和能量关系 | |
| C. | 图3表示反应CO+2H2═CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的$\frac{1}{2}$,平衡正向移动,氢气浓度增大 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,II表示醋酸,且溶液导电性c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com