
| 硫酸 化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g?cm-3 质量分数:98% |
| 1000ρw |
| M |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
| A、1:16 | B、16:1 |
| C、7:17 | D、7:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、②③ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2 |
| B、Na2SO3 |
| C、NaOH |
| D、AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应容器中压强不随时间变化 |
| B、容器中SO2、O2、SO3的物质的量之比为2:1:2 |
| C、SO2与SO3的浓度相等 |
| D、容器中SO2、O2、SO3共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
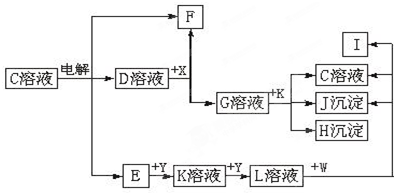
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油、柴油和植物油都是碳氢化合物 |
B、β-月桂烯的结构如图 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 |
| C、植物油通过加氢可以变为脂肪 |
| D、煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏制取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com