
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 .
. .
.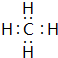 .
.分析 短周期元素中,C、E均有-2价,且C有+6价,原子半径大于E,故C为S元素、E为O元素;D有-1价,原子半径大于Be,故D为Cl;A、B化合价分别为+2、+3价,原子半径均大于硫,故A为Mg、B为Al;F原子中无中子,则F为H元素;G最高正价为负价绝对值相等,且最外层电子数是次外层的二倍,则G为碳元素;H元素单质熔色反应呈黄色,则H为Na,据此解答.
解答 解:短周期元素中,C、E均有-2价,且C有+6价,原子半径大于E,故C为S元素、E为O元素;D有-1价,原子半径大于Be,故D为Cl;A、B化合价分别为+2、+3价,原子半径均大于硫,故A为Mg、B为Al;F原子中无中子,则F为H元素;G最高正价为负价绝对值相等,且最外层电子数是次外层的二倍,则G为碳元素;H元素单质熔色反应呈黄色,则H为Na.
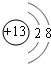
(1)B为Al元素,在元素周期表中的位置:第三周期ⅢA族,Al3+离子的结构示意图为 ,
,
故答案为:第三周期ⅢA族; ;
;
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4,故答案为:HClO4;
(3)C、H形成化合物为Na2S,用电子式表示其形成过程: ,
,
故答案为: ;
;
(4)H、E形成原子个数比为1:1的化合物为Na2O2,含有离子键、共价键,故答案为:离子键、共价键;
(5)F与G形成的最简单的化合物为CH4,电子式为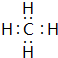 ,故答案为:
,故答案为: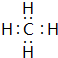 ;
;
(6)水分子之间存在氢键,硫化氢分子之间为范德华力,氢键比范德华力更强,故水的熔沸点高于硫氢化的,
故答案为:水分子之间存在氢键,硫化氢分子之间为范德华力,氢键比范德华力更强;
(7)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Mg2+>Al3+,
故答案为:S2->O2->Mg2+>Al3+.
点评 本题考查位置结构性质的关系及应用,推断元素是解题的关键,侧重对化学用语的考查,注意用电子式表示物质或化学键的形成,题目难度不大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| A. | X、Z、W的简单氢化物的稳定性Z>W>X | |
| B. | W元素的单质在化学反应中只表现还原性 | |
| C. | Y、Z、W的最高价氧化物均能与NaOH溶液反应 | |
| D. | X、Y的简单离子半径Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入溴的四氯化碳溶液发生反应 | |
| B. | 苯与浓硝酸、浓硫酸混和后加热至50℃~60℃发生反应 | |
| C. | 在苯中滴入溴水,振荡后溴水层褪色 | |
| D. | 乙烯通入酸性高锰酸钾溶液后溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将纯铁片放入稀硫酸中,反应缓慢,再加入少量硫酸溶液,可加快产生氢气的速率 | |
| B. | 用锌片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 | |
| C. | 反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| D. | 稀盐酸跟锌片反应,加入少量的氯化钠固体,反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2-+SO42-═BaSO4↓ | |
| B. | 氧化铜与稀硫酸混合:CuO+2H+═Cu2++H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH-═Cu(OH)2↓+SO42- | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

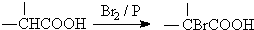
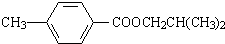 .
. ,该反应属于酯化反应(填反应类型).
,该反应属于酯化反应(填反应类型). .
.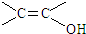 )结构.
)结构. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑥ | B. | ①③④⑦⑧ | C. | ③④⑤⑥⑦ | D. | ①②④⑤⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com