
以下有关化学用语描述正确的是
A.Mg2+的电子排布式:1s22s22p63s2 B.NH4Cl的电子式:
C.氨气的空间结构:三角锥形 D.甲醛结构简式:CH2O
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
(1)利用如图装置,可以模拟铁的电化学防护。
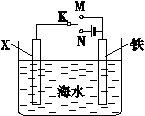
若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。
(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的一极为 极,该极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(3)碘被称为 “智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,可通过电解制备碘酸钾。(阴、阳两极均用惰性电极,阴极室与阳极室用阳离子交换膜隔开)请回答下列问题:电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl―、OH―;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.3︰2︰1 B. 2︰3︰1 C. 2︰4︰1 D.4︰2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温常压下,可利用下列装置来测定气体体积,抽气装置E用以调节装置中的气压差,减小实验误差。
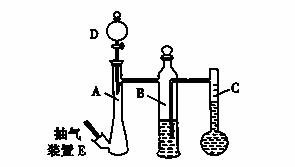
(1)若称取0.113g镁带与10.00 mL稀硫酸(足量)完全反应制取氢气,并测定1mol H2的体积(在常温常压下测定)。反应结束时C中的液面刻度为128.00 mL(A中未加硫酸时C中无液体),则得此条件下1mol H2的体积为________L(精确到0.001)。
(2)上述测出1mol H2的体积比该温度和压强下的理论值偏高的原因是(假设操作和装置都无问题)________(选填编号,下同)
A.未冷却到室温 B.反应太快
C.装置气密性不好 D.B装置漏气
(3)若利用上述装置测定CO2的气体摩尔体积。
①B中所盛放的液体应为________。
A.饱和Na2CO3溶液 B.饱和NaHCO3溶液
C.水 D.澄清石灰水
②仪器A、D中盛放的试剂应为________。
A.大理石,浓盐酸 B.纯碳酸钠,稀硫酸
C.纯碳酸钙,稀硫酸 D.纯碳酸钠,稀盐酸
(4)用以上装置测出的气体摩尔体积均比理论值大,你认为减小实验误差可行的措施是_______。
A.把A装置浸入盛水(常温)的水槽中
B.减小酸的浓度
C.把A装置浸入盛热水的水槽中
D.增大酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种短周期元素在周期表中的位置如右图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是
A.气态氢化物的沸点:Z<Y B.Z元素的氧化物对应的水化物一定是一种强酸
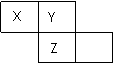 C.三种元素原子半径的大小顺序为: X>Y>Z X Y
C.三种元素原子半径的大小顺序为: X>Y>Z X Y
D.Z单质与Fe反应生成的化合物中,铁元素显+3价 Z
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
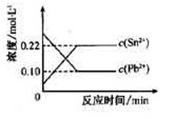 Sn(s)+Pb2+(aq)
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.25℃时,该反应的平衡常数K=2.2
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
对于100mL 1moL/L盐酸与锌粒的反应,采取下列措施能使放出H2速率加快的是( )
①升高温度 ②改用100mL 1mol/L硫酸 ③多用300mL 1mol/L盐酸;
④用等量锌粉代替锌粒 ⑤改用100mL 6mol/L硝酸 ⑥滴入几滴硫酸铜溶液
⑦用粗锌代替纯锌使用
A.①②④⑥⑦ B.①③④⑤⑦ C.②③④⑤⑥ D.①②③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3,分别填入下面对应的横线上,组成一个化学方程式并配平。
⑴.□ + □ = □ + □ + □ +□H2O
⑵.反应物中发生氧化反应的物质 ,被还原的元素是 。
⑶.反应中1mol氧化剂 (填“得到”或“失去”) mol电子。
⑷.HNO3在上述反应中表现出来的性质是 。(填选项编号)
A.酸性 B.氧化性 C.还原性 D.热不稳定性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com