
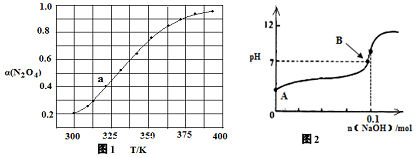
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | A、B、C三点溶液中水电离出来的c(OH-):A>B>C | |
| D. | C点时,盐酸和氨水恰好完全反应 |
分析 A、加少量水促进氨水的电离,但溶液中铵根离子和氢氧根离子的浓度都减小,温度不变水的离子积是一个常数,所以隐性离子氢离子的浓度变大;
B、由图可知,盐酸和氨水等体积混合,溶液的PH=7,则c(OH-)=c(H+)=1×10-7mol/L,所以c(NH4+)=c(Cl-)=$\frac{0.01}{2}$=0.005mol/L,则c(NH3•H2O)=$(\frac{a}{2}-0.005)mol/L$,根据Kb的表达式代入相关数据进行计算;
C、显性离子氢氧根离子浓度越大,水电离出的氢离子的浓度越小;
D、由图可知C点时,溶液呈中性.
解答 解:A、加少量水促进氨水的电离,但溶液中铵根离子和氢氧根离子的浓度都减小,温度不变水的离子积是一个常数,所以隐性离子氢离子的浓度变大,所以A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$增大,故A错误;
B、由图可知,盐酸和氨水等体积混合,溶液的PH=7,则c(OH-)=c(H+)=1×10-7mol/L,所以c(NH4+)=c(Cl-)=$\frac{0.01}{2}$=0.005mol/L,则c(NH3•H2O)=$(\frac{a}{2}-0.005)mol/L$,根据Kb=$\frac{0.005×1×1{0}^{-7}}{\frac{a}{2}-0.005}$=1.75×10-5,解得a=1.006×10-2mol•L-1,故B正确;
C、显性离子氢氧根离子浓度越大,水电离出的氢离子的浓度越小,所以水电离出的氢氧根离子浓度的大小为:A<B<C,故C错误;
D、C点时,如果盐酸和氨水恰好完全反应生成氯化铵,溶液呈酸性,而C点溶液呈中性,所以氨水过量,故D错误;
故选B.
点评 本题考查较综合,涉及弱电解质的电离、酸碱混合溶液定性判断、离子浓度的大小的比较等知识点,侧重考查学生分析计算能力,注意弱电解质电离平衡常数与其对应弱离子水解程度关系,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | a<c+d | B. | A的转化率增大 | ||
| C. | D的体积分数变大 | D. | 平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液和胶体的本质区别为是否能产生丁达尔效应 | |
| B. | K2Cr2O7溶液和氢溴酸能存放于同一药品橱内 | |
| C. | 用带玻璃塞的细口试剂瓶保存氢氟酸 | |
| D. | CH4和C2H4均属于常用危险品中的易燃气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
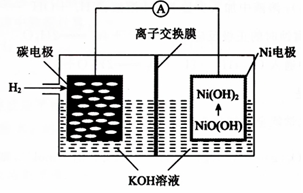
| A. | 离子交换膜选用阳离子交换膜(只允许阳离子通过) | |
| B. | 正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| C. | 导线中通过1mol电子时,理论上负极区溶液质量增加1g | |
| D. | 充电时,碳电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
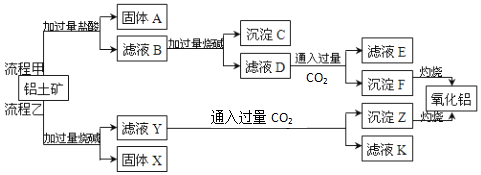
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
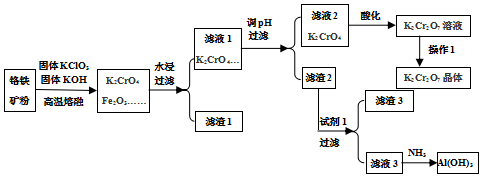
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
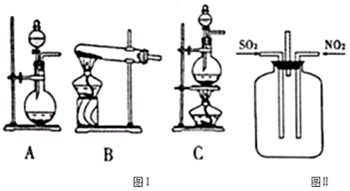
| 操作步骤 | 实验现象 | 结论 |
| 取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份. | ||
| 一份加入足量稀盐酸后,再加入BaCl2溶液. | 有白色沉淀生成. | 证明雾霾固体中含有SO42- |
| 另一份加入适量的NaOH浓溶液并加热. | 产生使湿润的红色石蕊试纸变蓝色的气体. | 证明雾霾固体中含有NH4+.综合上面实验,说明雾霾固体颗粒中含有(NH4)2SO4. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com