
铝土矿的主要成分是![]() ,还含有
,还含有![]() 、
、![]() 等杂质。
等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:

(1)试剂A是 ;溶液b与试剂B反应的离子方程式为 。
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)电解时,阳极的电极反应方程式为 ;每生产0.324吨铝,理论上转移电子的物质的量为 mol。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: ![]()
![]()
![]()
![]()
![]() CO(请配平)
CO(请配平)
②氯化铝与氨气高温合成法:![]()
![]()
![]()
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:

| ||
| 冰晶石 |
| ||
| 冰晶石 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
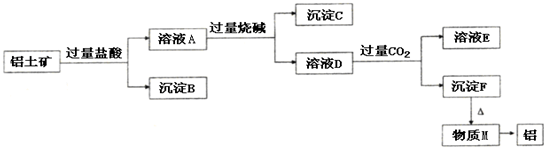
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com