
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
分析 A、求出丙醇的物质的量,然后根据丙醇中含11条共价键来分析;
B、HCO3-在溶液中能电离为CO32-和水解为H2CO3;
C、求出二氧化碳的物质的量,然后根据二氧化碳和过氧化钠反应时,当1mol二氧化碳参与反应时,反应转移1mol电子;
D、H218O与D2O的摩尔质量均为20g/mol,且均含10个中子.
解答 解:A、60g丙醇的物质的量为1mol,而丙醇中含11条共价键,故1mol丙醇中含11NA条共价键,故A错误;
B、HCO3-在溶液中能电离为CO32-和水解为H2CO3,根据物料守恒可知,溶液中的HCO3-、CO32-、H2CO3之和为0.1NA个,故B错误;
C、标况下5.6L二氧化碳的物质的量为0.25mol,而二氧化碳和过氧化钠反应时,当1mol二氧化碳参与反应时,反应转移1mol电子,故当0.25mol二氧化碳反应时,转移0.25NA个电子,故C错误;
D、H218O与D2O的摩尔质量均为20g/mol,故2.0g混合物的物质的量为0.1mol,且两者均含10个中子,故0.1mol混合物中含NA个中子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可乐饮料中含有的兴奋性物质咖啡因(C8H10O2N4)属于有机物 | |
| B. | 医疗上,碳酸氢钠是治疗胃穿孔的一种药剂 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 日常食用的冰糖、麦芽糖都属于单糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH的摩尔质量是40g/mol | |
| B. | 1mol H2的质量与它的相对分子质量相等 | |
| C. | 1mol H2O在标准状况下的体积约为22.4L | |
| D. | 氧气的摩尔质量在数值上等于它的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都可以用 | B. | 只能用③ | C. | 可以用①或② | D. | 可以用③或④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
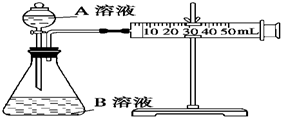 甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):| 序号 | A溶液 | B溶液 |
| ① | 2mL0.1mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL0.2mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 序号 | 溶液 | 条件 |
| ③ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 热水 |
| ④ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 冷水 |
| 时间(min) | 0-4 | 4-8 | 8-12 | 12-16 | 16-21 | 21-22 | 22-23 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 |
| υ(KMnO4)(10-4mol/(L•min) | a | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com