
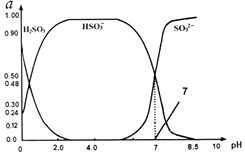
 常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )| A. | 由图中数据可计算得到常温下亚硫酸溶液的Ka2 | |
| B. | 在0.1mol•L-1H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 向pH为7的溶液中滴入少量稀盐酸造成的溶液pH变化小于向pH为4.0的溶液中滴入相同量稀盐酸造成的溶液pH变化 | |
| D. | 在pH=2.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) |
分析 A.亚硫酸为二元弱酸,其电离分步进行;结合图象计算亚硫酸的Ka2;
B.根据亚硫酸溶液中的电荷守恒进行分析;
C、pH为4的溶液中主要存在H2SO3?H++HSO3-,pH为7的溶液中主要存在HSO3-?H++SO32-,据此分析;
D、根据图象数据可知,pH=2.0时:c(HSO3-)>c(H2SO3).
解答 解:A.H2SO3是二元弱酸,在溶液中电离是分步进行的,亚硫酸的第一步电离方程式为:HSO3-?H++SO32-,根据图象可知,pH=7时,亚硫酸根离子与亚硫酸氢根离子浓度相等,则Ka2=10-7,故A正确;
B.在0.10 mol•L-1 H2SO3溶液中,根据电荷守恒可得:c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),将电苻守恒式两边都乘c(H+)可得:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+c(H+)•c(OH-),Kw=c(H+)•c(OH-),所以c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw,故B正确;
C、pH为4的溶液中主要存在H2SO3?H++HSO3-,pH为7的溶液中主要存在HSO3-?H++SO32-,分别滴入相同量稀盐酸,氢离子浓度增大,平衡逆向移动,亚硫酸和亚硫酸根离子浓度增大,但亚硫酸电离程度大于亚硫酸根离子电离程度,所以pH为4 的溶液pH变化大,故C正确;
D、在pH=2.0的溶液中,根据图象曲线可知各离子浓度大小为:c(HSO3-)>c(H2SO3)>c(H+)>c(OH-),故D错误;
故选D.
点评 本题考查弱电解质的电离平衡及其影响,题目难度中等,明确图象中曲线变化的含义为解答关键,注意掌握电荷守恒、物料守恒及质子守恒在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 二氧化碳 | 碳酸钠 | 转移的电子 |
| A | lmol | 2NA | |
| B | 22.4L | lmol | |
| C | 106g | lmol | |
| D | 106g | 2NA |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下纯水PH=6,则在该条件下PH=4的醋酸和PH=10的NaOH中水的电离程度相同 | |
| B. | NH4Cl溶于D2O的离子方程式:NH4+D2O?NH3•D2O+H+ | |
| C. | 已知S燃烧热为QKJ/mol,则S(s)+$\frac{3}{2}$O2(g)═SO3(g);△H=-QKJ/mol | |
| D. | 水的自偶电离方程式:2H2O?H3O-+OH-,则液氨自偶电离:2NH3?NH4++NH2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于2.0Kpa | B. | 等于1.5Kpa | C. | 大于1.5bKpa | D. | 小于1.5bKpa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同元素的原子结构的分子只含极性共价键 | |
| B. | 137Cs和133Cs是中子数不同质子数相同的同种核素 | |
| C. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| D. | 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次教学诊断化学卷(解析版) 题型:选择题
一块11.0 g的铁铝合金,加入一定量的稀硫酸后完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 mol·L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法不正确的是
A.该合金中铁的质量为5.6 g
B.该合金与稀硫酸反应共生成0.45 mol H2
C.该合金与足量氢氧化钠溶液反应,转移的电子数为0.6NA
D.所加的稀硫酸中含0.6 mol H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com