
【题目】在298K,1.01×105Pa下,将22g CO2通入750mL 1molL﹣1 NaOH的溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1mol CO2通入1L 2molL﹣1 NaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)═NaHCO3(aq)△H=﹣(2y﹣x)kJmol﹣1
B.CO2(g)+NaOH(aq)═NaHCO3(aq)△H=﹣(4x﹣y)kJmol﹣1
C.CO2(g)+NaOH(aq)═NaHCO3(aq)△H=﹣(2x﹣y)kJmol﹣1
D.2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=﹣(8x﹣2y)kJmol﹣1
【答案】B
【解析】解:根据题意,22gCO2通入1molL﹣1NaOH溶液750mL中充分反应,n(CO2)= ![]() =0.5mol,n(NaOH)=1molL﹣1×0.75L=0.75mol, 该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
=0.5mol,n(NaOH)=1molL﹣1×0.75L=0.75mol, 该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
由0.5molCO2反应放出热量为xKJ,则2molCO2反应放出热量为4xKJ,即热化学反应方程式为
2CO2(g)+3NaOH(aq)═NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=﹣4xKJ/mol①,
又1mol CO2通入2molL﹣1NaOH溶液1L中充分反应放出y kJ的热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=﹣yKJ/mol②,
由盖斯定律可知,①﹣②可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=﹣(4x﹣y)KJ/mol,
故选B.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物。(夹持装置已略去,装置的气密性良好)
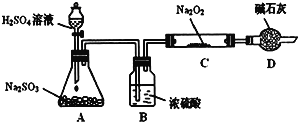
Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是:_________________________。装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:_________________。
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:__________。 假设2:只有Na2SO4; 假设3:既有Na2SO3又有Na2SO4。
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:_____________________。
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如下实验:
![]()
得出结论:C中固体产物只有Na2SO4。该方案是否合理?答:__________。(填“是”或“否”)理由是______________________________。
(3)乙同学为证明假设3成立,设计如下实验。
实验步骤和结论为:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1molL-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有_________;
③滴加适量的1molL-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O―→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。已知FeCO3易被氧化:4FeCO3+6H2O+O2===4Fe(OH)3+4CO2。某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:
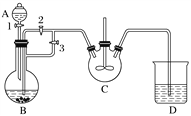
回答下列问题:
(1)NH4HCO3盛放在装置__________(填字母)中,该装置中涉及的主要反应的离子方程式________________________________________________________________________。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是____________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75 ℃下搅拌反应。铁粉的作用是________________________________________________________________________,反应结束后,无需过滤,除去过量铁粉的方法是_________________________________.
(4)经查阅文献后,该兴趣小组用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL,进行必要处理,用0.100 0 mol·L-1 Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70 mL。滴定反应如下:Ce4++Fe2+===Ce3++Fe3+,则产品中乳酸亚铁的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛{部分夹持仪器已略去)。

资料表明:室温下,四氯化钛为无色液体,熔点:-25℃,沸点:136.4℃。在空气中与水蒸气发生反应,形成发烟现象,生成二氧化钛固体。在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)A处分液漏斗上方的胶皮管的作用是_______;
(2)实验中B装置中选用的试剂为______,该装置的作用是_________;
(3)D中物质制备的化学方程式为_________;
(4)E处球形冷凝管的作用是__________,该装置冷却水应从______(填“c”或“d")口通入;
(5)仪器F中盛装的物质是__________;
(6)该实验设计略有缺陷,请指出其不足之处: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质,G、J的焰色均为黄色。反应①为炼铁高炉中的重要反应;反应②可用于焊接铁轨。
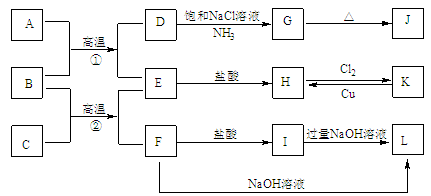
请回答下列问题:
(1)B的化学式为 ,J的化学式为 。
(2)工业上将氯气通入石灰乳中制取漂白粉,该反应的化学反应方程式为 。
(3)D→G是侯氏制碱法的主要反应,该反应的化学方程式为 。
(4)K→H是制作印刷电路板的重要反应,该反应的离子方程式为 。
(5)F→L是铝土矿提纯中的重要反应,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去括号内杂质所用试剂和方法不正确的是
A. CO2(HCl)——氢氧化钠溶液,洗气
B. KNO3(NaCl)——结晶
C. 水(NaCl)——蒸馏
D. Cu(Fe)——溶于足量盐酸,过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com