
ЁОЬтФПЁПЖОжиЪЏЕФжївЊГЩЗжBaCO3(КЌCa2ЃЋЁЂMg2ЃЋЁЂFe3ЃЋЕШдгжЪ)ЃЌЪЕбщЪвРћгУЖОжиЪЏжЦБИBaCl2ЁЄ2H2OЕФСїГЬШчЯТЃК
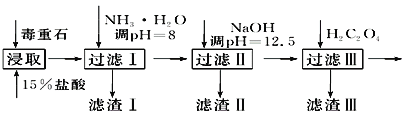
ЃЈ1ЃЉЖОжиЪЏгУбЮЫсНўШЁЧАашГфЗжбаФЅЃЌФПЕФЪЧ_______________________________________ЃЛЪЕбщЪвгУ37%ЕФбЮЫсХфжЦ15%ЕФбЮЫсЃЌГ§СПЭВЭтЛЙашЪЙгУЯТСавЧЦїжаЕФ________ЁЃ
aЃЎЩеБ bЃЎвЛЖЈШнЛ§ЕФШнСПЦП cЃЎВЃСЇАє dЃЎЕЮЖЈЙм
ЃЈ2ЃЉВщдФгаЙизЪСЯЛёЕУГСЕэИїжждгжЪРызгЕФpHМћЯТБэЃК
ГСЕэдгжЪРызг | Ca2ЃЋ | Mg2ЃЋ | Fe3ЃЋ |
ПЊЪМГСЕэЪБЕФpH | 11.9 | 9.1 | 1.9 |
ЭъШЋГСЕэЪБЕФpH | 13.9 | 11.1 | 3.2 |
МгШыNH3ЁЄH2OЕїНкpHЃН8ПЩГ§ШЅ______(ЬюРызгЗћКХ)ЃЛТЫдќЂђжаКЌ__________(ЬюЛЏбЇЪН)ЁЃМгШыH2C2O4ЪБгІБмУтЙ§СПЃЌдвђЪЧ_____________________ЃЈвбжЊЃКKsp(BaC2O4)ЃН1.6ЁС10Ѓ7ЃЌKsp(CaC2O4)ЃН2.3ЁС10Ѓ9ЃЉЁЃ
ЃЈ3ЃЉРћгУМфНгЫсМюЕЮЖЈЗЈПЩВтЖЈBa2ЃЋЕФКЌСПЃЌЪЕбщЗжСНВННјааЁЃвбжЊЃК2CrO![]() ЃЋ2HЃЋ===Cr2O
ЃЋ2HЃЋ===Cr2O![]() ЃЋH2OЁЁBa2ЃЋЃЋCrO
ЃЋH2OЁЁBa2ЃЋЃЋCrO![]() ===BaCrO4Ё§
===BaCrO4Ё§
ВНжшЂёЃЎзМШЗвЦШЁx mLвЛЖЈХЈЖШЕФNa2CrO4ШмвКгкзЖаЮЦПжаЃЌМгШыМИЕЮЫсМюжИЪОМСЃЌгУb molЁЄLЃ1бЮЫсБъзМвКЕЮЖЈжСжеЕуЃЌВтЕУЕЮМгбЮЫсЬхЛ§ЮЊV0 mLЁЃ
ВНжшЂђЃЎзМШЗвЦШЁy mL BaCl2ШмвКгкзЖаЮЦПжаЃЌМгШыx mLгыВНжшЂё ЯрЭЌХЈЖШЕФNa2CrO4ШмвКЃЌД§Ba2ЃЋЭъШЋГСЕэКѓЃЌдйМгШыЫсМюжИЪОМСЃЌгУb molЁЄLЃ1бЮЫсБъзМвКЕЮЖЈжСжеЕуЃЌВтЕУЕЮМгбЮЫсЕФЬхЛ§ЮЊV1mLЁЃ
ЕЮМгбЮЫсБъзМвКЪБгІгУЫсЪНЕЮЖЈЙмЃЌЁА0ЁБПЬЖШЮЛгкЕЮЖЈЙмЕФ________(бЁЬюЁАЩЯЗНЁБЛђЁАЯТЗНЁБ)ЁЃBaCl2ШмвКЕФХЈЖШЮЊ________________molЁЄLЃ1ЃЌШєВНжшЂђжаЕЮМгбЮЫсЪБгаЩйСПД§ВтвКНІГіЃЌдђЫљВтЕУBa2ЃЋХЈЖШВтСПжЕНЋ________(бЁЬюЁАЦЋДѓЁБЛђЁАЦЋаЁЁБ)ЁЃ
ЁОД№АИЁП діДѓдСЯЕФНгДЅУцЛ§ЃЌМгПьНўШЁЫйТЪ a c Fe3ЃЋ Mg(OH)2ЁЂCa(OH)2 H2C2O4Й§СПЛсЕМжТЩњГЩBaC2O4ГСЕэЃЌжТВњЦЗЕФВњСПМѕЩй ЩЯЗН ![]() ЦЋДѓ
ЦЋДѓ
ЁОНтЮіЁПЃЈ1ЃЉГфЗжбаФЅПЩвддіДѓЗДгІЮяЕФНгДЅУцЛ§ЃЌдіДѓЗДгІЫйТЪЃЛвђЮЊХфжЦЕФбЮЫсШмвКХЈЖШЮЊжЪСПЗжЪ§ЃЌПЩвдМЦЫуГіХЈбЮЫсЕФЬхЛ§КЭЫЎЕФЬхЛ§ЃЌЫљвдЪЙгУЩеБзїЮЊШнЦїЯЁЪЭЃЌВЃСЇБНСАшЁЃ
ЃЈ2ЃЉИљОнСїГЬЭМКЭБэжаЪ§ОнЃЌМгШыNH3H2OЕїpHЮЊ8ЃЌжЛгаFe3+ЭъШЋГСЕэЃЌЙЪПЩГ§ШЅFe3+ЃЛМгШыNaOHЕїpH=12.5ЃЌMg2+вВЭъШЋГСЕэЃЌCa2+ВПЗжГСЕэЃЌЫљвдТЫдќЂђжаКЌMg(OH)2ЁЂCa(OH)2ЃЛИљОнKspЃЈBaC2O4ЃЉ=1.6ЁС10-7ЃЌH2C2O4Й§СПЪБBa2+зЊЛЏЮЊBaC2O4ГСЕэЃЌBaCl2ЁЄ2H2OВњЦЗЕФВњСПМѕЩйЁЃ
ЃЈ3ЃЉЁА0ЁБПЬЖШЮЛгкЕЮЖЈЙмЕФЩЯЗНЃЛгыBa2+ЗДгІЕФCrO42ЕФЮяжЪЕФСПЮЊЃЈV0bЁЊV1bЃЉ/1000molЃЌдђBa2+ХЈЖШЮЊЃЈV0bЁЊV1bЃЉ/yЃЛИљОнМЦЫуЪНЃЌШєВНжшЂђжаЕЮМгбЮЫсЪБгаЩйСПД§ВтвКНІГіЃЌV1МѕаЁЃЌдђBa2+ХЈЖШВтСПжЕНЋЦЋДѓЁЃ


 ЕМбЇНЬГЬИпжааТПЮБъЯЕСаД№АИ
ЕМбЇНЬГЬИпжааТПЮБъЯЕСаД№АИ аЁбЇПЮЪБЬибЕЯЕСаД№АИ
аЁбЇПЮЪБЬибЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАЂЗќМгЕТТоГЃЪ§ЕФжЕЮЊ NAЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. АЂЗќМгЕТТоГЃЪ§ОЭЪЧ6.02ЁС1023
B. КЌгаАЂЗќМгЕТТоГЃЪ§ИіСЃзгЕФЮяжЪЕФСПЪЧ1mol
C. 1molNH3ЫљКЌдзгЪ§дМЪЧ2.408ЁС1023
D. БъзМзДПіЯТЃЌ2.24LSO3ЗжзгЪ§ЮЊ0.1NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщШмвКЭЌЪБПЊЪМЗДгІЃЌзюЯШГіЯжЛызЧЯжЯѓЕФЪЧЃЈ ЃЉ
зщ Б№ | ЗДгІ ЮТЖШ ЃЈЁцЃЉ | ЗДгІЮя | МгЫЎ ЬхЛ§ ЃЈmlЃЉ | |||
Na2S2O3 | H2SO4 | |||||
ЬхЛ§ ЃЈmlЃЉ | ХЈЖШ ЃЈmol/LЃЉ | ЬхЛ§ ЃЈmlЃЉ | ХЈЖШ ЃЈmol/LЃЉ | |||
A | 40 | 5 | 0.2 | 5 | 0.1 | 10 |
B | 10 | 10 | 0.1 | 10 | 0.1 | 0 |
C | 10 | 5 | 0.1 | 5 | 0.2 | 10 |
D | 40 | 5 | 0.2 | 5 | 0.2 | 10 |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїЮяжЪжаКЌЕЊдзгЪ§зюЖрЕФЪЧ( )
A. 0.1molNH4Cl B. 0.1molNH4NO3
C. 1.204ЁС1023CO(NH2)2 D. 0.2mol NH3ЁЄH2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊгааЇПижЦЮэіВЃЌИїЕиЛ§МЋВЩШЁДыЪЉИФЩЦДѓЦјжЪСПЃЌбаОПВЂгааЇПижЦПеЦјжаЕФЕЊбѕЛЏЮяЁЂЬМбѕЛЏЮяКЌСПЯдЕУгШЮЊживЊЃЎ
ЃЈ1ЃЉЦћГЕФкШМЛњЙЄзїЪБЛсв§Ц№N2КЭO2ЕФЗДгІЃКN2+O2ЈT2NOЃЌЪЧЕМжТЦћГЕЮВЦјжаКЌгаNOЕФдвђжЎвЛЃЛдкT1ЁЂT2ЮТЖШЯТЃЌвЛЖЈСПЕФNOЗЂЩњЗжНтЗДгІЪБN2ЕФЬхЛ§ЗжЪ§ЫцЪБМфБфЛЏШчЭМ1ЫљЪОЃЌИљОнЭМЯѓХаЖЯЗДгІN2ЃЈgЃЉ+O2ЃЈgЃЉЈT2NOЃЈgЃЉЕФЁїH0ЃЈЬюЁАЃОЁБЛђЁАЃМЁБЃЉЃЎ 
ЃЈ2ЃЉNOxЪЧЦћГЕЮВЦјжаЕФжївЊЮлШОЮяжЎвЛЃЎЦћГЕЗЂЖЏЛњЙЄзїЪБЛсв§Ц№N2КЭO2ЗДгІЃЌЦфФмСПБфЛЏШчЭМ2ЫљЪОЃЌаДГіИУЗДгІЕФШШЛЏбЇЗНГЬЪН ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСазщКЯжаЃЌЪєгкЩњЮяДѓЗжзгЕФЪЧ
A. ЕААзжЪ B. ЦЯЬбЬЧ C. АБЛљЫс D. КЫмеЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ЗжзгОЇЬхжавЛЖЈДцдкЗжзгМфзїгУСІЃЌВЛвЛЖЈДцдкЙВМлМќ
B. ЗжзгжаКЌСНИіЧтдзгЕФЫсвЛЖЈЪЧЖўдЊЫс
C. КЌгаН№ЪєбєРызгЕФОЇЬхвЛЖЈЪЧРызгОЇЬх
D. дЊЫиЕФЗЧН№ЪєаЭдНЧПЃЌЦфЕЅжЪЕФЛюЦУадвЛЖЈдНЧП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШеГЃЩњЛюжаГЃгУЕНаэЖрЛЏбЇжЊЪЖЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
A. ШШЕФДПМюЃЈNa2CO3ЃЉЫЎШмвКЃЈЯдМюадЃЉПЩЧхЯДгЭЮл
B. НЋКЌгаМзДМЕФЙЄвЕОЦОЋЖвжЦГЩвћгУАзОЦ
C. ВЛФмгУЫеЕЄКьЃЈЩЋЫиЃЉзїЪГЦЗЕФзХЩЋМС
D. ВЯЫПКЭбђУЋЖМЪєгкЖЏЮяЯЫЮЌЃЌгжГЦЕААзЯЫЮЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвдЯТЪЧгаЙиSO2ЁЂCl2ЕФаджЪЪЕбщЃЎ
ЃЈ1ЃЉФГаЁзщЩшМЦШчЭМЫљЪОЕФзАжУЭМЃЈЭМжаМаГжКЭМгШШзАжУТдШЅЃЉЃЌЗжБ№баОПSO2КЭCl2ЕФаджЪЃЎ 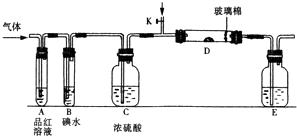
ШєДгзѓЖЫЗжБ№ЭЈШыSO2КЭCl2 ЃЌ зАжУAжаЙлВьЕНЕФЯжЯѓЪЧЗёЯрЭЌЃПЃЈЬюЁАЯрЭЌЁБЛђЁАВЛЯрЭЌЁБЃЉЃЛ ШєзАжУDжазАЕФЪЧЮхбѕЛЏЖўЗАЃЈДпЛЏМСЃЉЃЌЭЈШыSO2ЪБЃЌДђПЊKЭЈШыЪЪСПO2ЕФЛЏбЇЗДгІЗНГЬЪНЮЊEжаЪЂгаШмвКЃЎ
ЃЈ2ЃЉШєзАжУBжазАга5.0mL 1.0ЁС10Љ3mol/LЕтЫЎЃЌЕБЭЈШызуСПCl2ЭъШЋЗДгІКѓЃЌЙВзЊвЦСЫ5.0ЁС10Љ5molЕчзгЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЃЎ
ЃЈ3ЃЉФГЭЌбЇНЋзуСПЕФSO2ЭЈШывЛжЇзАгаТШЛЏБЕШмвКЕФЪдЙмЃЌЮДМћГСЕэЩњГЩЃЌШєЯђИУЪдЙмжаМгШызуСПЃЈЬюзжФИЃЉ ЃЌ дђПЩвдПДЕНАзЩЋГСЕэВњЩњЃЎ
A.АБЫЎ
B.ЯЁбЮЫс
C.ЯЁЯѕЫс
D.ТШЛЏИЦЃЎ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com