
| 所需数据取值范围 | 生成CO2气体的体积 | |
| 盐酸不足量时 | ||
| 盐酸足量时 |
| 4.60g |
| 100g/mol |
| 4.60g |
| 84g/mol |


科目:高中化学 来源: 题型:
| A、60gSiO2晶体中含有2×6.02×1023个Si-O键 |
| B、18gD2O(重水)完全电解,转移2×6.02×1023个电子 |
C、720gC60晶体(如图)中含有6.02×1023个晶胞结构单元 |
| D、14g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目为3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
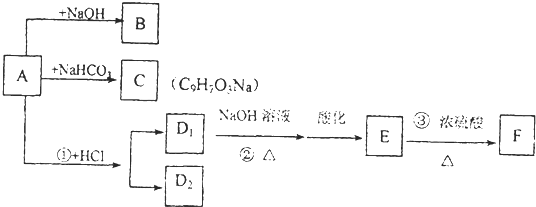
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg(HCO3)2溶液与澄清石灰水混合:Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O |
| B、FeCl3溶液中通入足量H2S气体:2Fe3++3S2-=2FeS↓+S↓ |
| C、AlCl3溶液中加入过量的氨水溶液:Al3++4OH-=AlO2-+2H2O |
| D、等物质的量的Ba(OH)2和 NH4HCO3在大量的水中混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
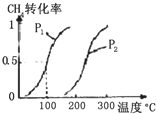 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) | ||
| I | 150 |
|
0.1 | ||
| II | 5 | ||||
| III | 350 | 5 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g D2O含有电子数为10 NA | ||
| B、标准状况下,11.2L乙酸中含有的分子数目为0.5 NA | ||
| C、6.2g氧化钠中含有的离子数为0.3NA | ||
D、200 mL 1 mol?L-1Fe2(SO4)3溶液中,Fe3+和SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)?2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)?2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是( )| A、反应开始时,B容器中化学反应速率快 |
| B、A容器中X的转化率为40%,且比B容器中X的转化率大 |
| C、打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计) |
| D、打开K达新平衡后,升高B容器温度,A容器体积一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | NaCl | KCl | NaClO3 | KClO3 | KOH |
| 价格(元/50kg) | 500 | 1900 | 4200 | 26000 | 10600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com