
| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | X端为电解池的阳极 |
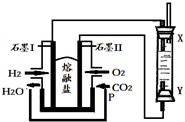
分析 左边装置是原电池,通入氢气的电极I是负极、通入氧气的电极II是正极,负极反应式为H2-2e-+CO32-═CO2+H2O,正极反应式为O2+4e-+2CO2=2CO32-,右边装置是电解池,X是阴极、Y是阳极,阴极反应式为2H2O+2e-=H2↑+2OH-、阳极反应式为Fe-2e-+2OH-=Fe(OH)2↓,据此分析解答.
解答 解:左边装置是原电池,通入氢气的电极I是负极、通入氧气的电极II是正极,负极反应式为H2-2e-+CO32-═CO2+H2O,正极反应式为O2+4e-+2CO2=2CO32-,右边装置是电解池,X是阴极、Y是阳极,阴极反应式为2H2O+2e-=H2↑+2OH-、阳极反应式为Fe-2e-+2OH-=Fe(OH)2↓,
A.X、Y两端,阳极X必须是铁电极,Y电极不需要一定用铁作电极,可以用石墨电极,故A错误;
B.电解过程是阴极上氢离子放电得到溶液中的氢氧根离子交换亚铁离子生成氢氧化亚铁,所以可以用NaOH溶液作为电解液,故B错误;
C.阴极发生的反应是溶液中的氢离子得到电子生成氢气,碱溶液中电极反应:2H2O+2e-=H2↑+2OH-,故C正确;
D.X连接原电池负极,所以是电解池阴极,故D错误;
故选C.
点评 本题考查原电池和电解池原理,正确判断原电池正负极及电解池阴阳极是解本题关键,难点是电极反应式的书写,注意该原电池中电解质是熔融碳酸盐而不是酸或碱溶液,题目难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重金属、农药和难分解有饥物等会造成水体污染 | |
| B. | 装饰材料中的甲醛、芳香烃及氡等会造成居室污染 | |
| C. | SO2、NO2或CO2都会导致酸雨的形成 | |
| D. | CO2和氟氯烃等物质的大量排放会造成温室效应的加剧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 6种一溴二甲苯的熔点/℃ | 234 | 206 | 213.8 | 204 | 214.5 | 205 |
| 对应二甲苯的熔点/℃ | 13 | -54 | -27 | -54 | -27 | -54 |
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Ca2+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | C6H5O-、Fe3+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的FeCl3溶液中,Fe3+离子个数小于NA | |
| B. | Al3+和S2-,NO3-和S2-两组离子在酸、碱和中性溶液中均不能大量共存 | |
| C. | Ca(HCO3)2溶液与过量NaOH溶液反应的离子方程式:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| D. | 向10 mL 0.1 mol•L-1 CH3COONa溶液中加入5 mL 0.1 mol•L-1盐酸时,溶液中c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | 实 验 | 结 论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 向样品溶液中先滴加过量的稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀,说明样品溶液中一定含有SO42- |
| C | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成,表明淀粉没有水解生成葡萄糖 |
| D | 向0.1mol•L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热 | 浅红色加深,说明Na2CO3的水解是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学式为C6H6O6 | |
| B. | 乌头酸能使酸性高锰酸钾溶液或溴水褪色 | |
| C. | 乌头酸能发生水解反应和加成反应 | |
| D. | 含l mol乌头酸的溶液最多可消耗3 mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com