
【题目】CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂.以生物质废液﹣﹣木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3CaCO3 , 含SiO2等杂质)等为原料生产CMA的实验流程如图1: 
(1)步骤①发生的反应离子方程式为 .
(2)步骤②所得滤渣1的主要成分为(写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是 .
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图2所示,步骤④的目的除调节n(Ca):n(Mg)约为(选填:1:2;3:7;2:3)外,另一目的是 .
(4)步骤⑥包含的操作有、过滤、洗涤及干燥.
【答案】
(1)MgCO3?CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO﹣+2CO2↑+2H2O
(2)SiO2;实验过程中苯酚被空气中氧气氧化最终产生褐色物质
(3)3:7;除去过量的乙酸
(4)蒸发结晶
【解析】解:根据流程图可知,白云石(主要成分MgCO3CaCO3 , 含SiO2等杂质)与木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性碳脱色,除去被氧化的苯酚、焦油等杂质,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA,
(1.)根据上面的分析可知,步骤①发生的反应离子方程式为 MgCO3CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO﹣+2CO2↑+2H2O,
所以答案是:MgCO3CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO﹣+2CO2↑+2H2O;
(2.)步骤②所得滤渣1的主要成分为二氧化硅,化学式为SiO2 , 步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是实验过程中苯酚被空气中氧气氧化最终产生褐色物质,所以答案是:SiO2;实验过程中苯酚被空气中氧气氧化最终产生褐色物质;
(3.)根据如图2所示钙、镁的物质的量之比与出水率(与融雪效果成正比)关系,可知,当n(Ca):n(Mg)约为3:7时,出水率最高,所以步骤④的目的除调节n(Ca):n(Mg)约为3:7,步骤④中加入氧化镁的另一个目的是与溶液中的醋酸反应,除去过量的乙酸,所以答案是:3:7;除去过量的乙酸;
(4.)根据上面的分析可知,步骤⑥包含的操作有 蒸发结晶、过滤、洗涤及干燥,所以答案是:蒸发结晶.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.5L的恒容密闭容器中发生反应:CO2(g)+H2S(g)COS(g)+H2O(g)
容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
Ⅰ | 607 | 0.11 | 0.41 | 0.01 | / |
Ⅱ | 607 | 0.22 | 0.82 | / | |
Ⅲ | 620 | 0.1 | 0.4 | / | 6.74×10﹣3 |
下列说法正确的是( )
A.该反应正反应为放热反应
B.607K时该反应的平衡常数为2.50×10﹣3
C.容器Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D.容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A.乙醇不能发生取代反应
B.C4H10有三种同分异构体
C.氨基酸、淀粉均属于高分子化合物
D.乙烯和甲烷可用溴的四氯化碳溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O,K2Cr2O7+14HCl(浓)2KCl+2CrCl3+3Cl2↑+7H2O, MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其中KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(大于6 molL-1)反应,MnO2需和浓盐酸(大于8 molL-1)反应。根据以上信息,下列结论中不正确的是
MnCl2+Cl2↑+2H2O,其中KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(大于6 molL-1)反应,MnO2需和浓盐酸(大于8 molL-1)反应。根据以上信息,下列结论中不正确的是
A. 上述反应都属于氧化还原反应 B. 生成1 mol Cl2转移电子数均为2NA
C. 盐酸浓度越大,Cl—的还原性越强 D. 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是( ) ①已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1 , 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
上表数据可以计算出 ![]() (g)+3H2(g)→
(g)+3H2(g)→ ![]() (g)的反应热;
(g)的反应热;
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A.①②③④
B.③④⑤
C.④⑤
D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.56×10﹣10 , Ksp(Ag2CrO4)=1×10﹣12 . 下列关于该温度下的叙述正确的是( )
A.向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl)减小
B.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
C.若向0.0008molL﹣1的K2CrO4溶液中加入等体积0.002 molL﹣1的AgNO3溶液,则CrO42﹣﹣完全沉淀
D.若将0.001molL﹣1AgNO3溶液滴入浓度均为0.001 molL﹣1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氯化亚铜(一种难溶于水的白色固体)的流程如下:
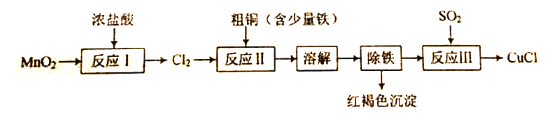
(1)“反应I”在加热条件下进行,同时有MnCl2生成,该反应的化学方程式为 __。
(2) “反应Ⅱ”中杂质与Cl2反应的化学方程式为__。 ⑶实验所用SO2气体可由铜和浓硫酸反应制得,该反应的化学方程式为__。
(4)“反应Ⅲ”的离子方程式为___。
(5)若将等物质的量的S02、Cl2通入水中,所得溶液几乎没有漂白性,该反应的离子方程式为___。
【答案】 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 2Fe+3Cl2![]() 2FeCl3 Cu+2H2SO4 (浓)
2FeCl3 Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO
CuSO4+SO2↑+2H2O SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO![]() +4H+ Cl2+SO2+2H2O=4H++SO
+4H+ Cl2+SO2+2H2O=4H++SO![]() +2Cl-
+2Cl-
【解析】(1)MnO2与浓盐酸反应生成MnCl2和Cl2,Mn元素化合价由+4价降低为+2价,盐酸中Cl元素化合价降为0价,根据元素守恒,反应有水生成,可得MnO2+HCl(浓) —MnCl2+Cl2↑+H2O,根据化合价升降守恒配平方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)粗铜中含有少量铁,通入Cl2,将Cu氧化为CuCl2,将Fe氧化为FeCl3,生成FeCl3的反应方程式为2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(3)铜和浓硫酸反应制SO2,反应方程式为Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)将CuCl2、FeCl3固体溶解后,再将铁离子转化为红褐色的氢氧化铁沉淀,过滤除铁,得到溶液CuCl2。向溶液中通入SO2,生成目标产物CuCl,Cu元素化合价降低,被还原,则SO2被氧化为SO42-,离子方程式为SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(5)若将等物质的量的SO2、Cl2通入水中,恰好完全反应生成硫酸和盐酸,所得溶液没有漂白性,离子方程式为Cl2+SO2+2H2O=4H++SO42-+2Cl-。
【题型】综合题
【结束】
23
【题目】有关物质的转化关系如下图所示(反应中部分物质已略去)。A、C、G、K、M 为单质,其中G、K、L、M 为气体,其中M能使带火星的木条复燃,D可用作耐高温材料,为黑色磁性氧化物, E为常见的强碱。
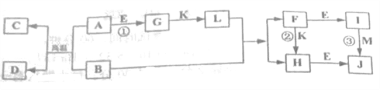
(1)D的化学式为__。
(2)写出反应①的离子方程式:__。
(3)写出反应②的离子方程式:__。
(4)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)2Z(g)、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图所示:下列判断正确的是( ) 
A.反应①的正反应是吸热反应
B.达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(Ⅰ)时,X的转化率为 ![]()
D.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com