
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是

A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
【答案】D
【解析】
A、点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),由电荷守恒可知: c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故A错;
B、点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),故B错;
C、点③说明两溶液恰好完全反应生成CH3COONa,由于CH3COO-水解,且程度较小,所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错;
D、当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D正确,答案选D。


科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、X、Y六种物质均由短周期元素组成,其中X为常见离子化合物,它们之间的转换关系如下图所示

(1)已知条件I和条件II相同,则该反应条件为____________________ 。
(2)物质X的电子式为_____________________ 。
(3)写出B与Ca(OH)2反应的化学方程式______________________________ 。
(4)写出X在条件II下反应生成B、C、D的离子方程式_____________________________________________ 。
(5)写出实验室制B的化学方程式,并标出电子转移方向、数目____________________________________________ 。
(6)请简述鉴定物质X的实验方法____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
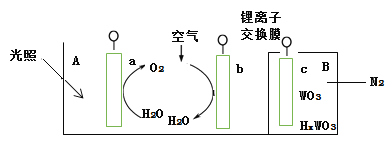
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pNi=-lgc(Ni2+);常温下,K(NiCO3)=1.4×10-7,H2S的电离平衡常数:Ka1=1.3×10-7,Ka2=7.1×10-15。常温下,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法不正确的是( )。
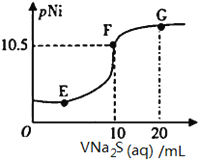
A. E、F、G三点中,F点对应溶液中水电离程度最小
B. 常温下,Ksp(NiS)=1×10-21
C. 在NiS和NiCO3的浊液中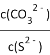 =1.4×1014
=1.4×1014
D. Na2S溶液中,S2-第一步水解常数Kh1=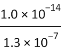
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究酸雨对低碳钢腐蚀的影响,实验流程如图:

实验使用了3种模拟酸雨。模拟酸雨中的离子浓度如表所示,其中平衡电荷的阳离子以NH![]() 或Na+补充,实验均在室温下进行,低碳钢片样品的大小和质量均相同。
或Na+补充,实验均在室温下进行,低碳钢片样品的大小和质量均相同。

(1)将模拟酸雨1和模拟酸雨2进行对比实验,实验的目的是___。模拟酸雨3对钢片的腐蚀速率大于模拟酸雨2对钢片的腐蚀速率,可以得到结论是___。
(2)在用模拟酸雨2进行实验时,腐蚀冲洗液中检测到Fe2+和NH![]() 的含量升高。腐蚀时硝酸和铁反应的离子方程式为___。
的含量升高。腐蚀时硝酸和铁反应的离子方程式为___。
(3)在上述三组腐蚀实验中,都检测到钢片内部持续产生腐蚀电流。产生腐蚀电流的原因是___。
(4)钢铁的腐蚀研究中,通常用“腐蚀速率(单位为mg·h-1)"对钢铁腐蚀过程和结果进行评估。则计算“腐蚀速率”需要测量的实验数据为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋占据地球面积的![]() ,拥有丰富的资源,从海洋中可以提取钠、镁、溴、碘等物质。提取溴的过程有一步反应的离子方程式:
,拥有丰富的资源,从海洋中可以提取钠、镁、溴、碘等物质。提取溴的过程有一步反应的离子方程式:![]() 。下列叙述错误的是
。下列叙述错误的是
A.![]() 为还原剂B.
为还原剂B.![]() 既不是氧化剂,又不是还原剂
既不是氧化剂,又不是还原剂
C.生成![]() ,转移
,转移![]() 电子D.
电子D.![]() 仅为氧化产物
仅为氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
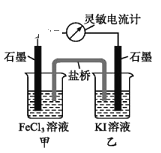
A.反应开始时,乙中石墨电极上发生氧化反应
B.电流计读数为零时,反应达到化学平衡状态
C.电流计读数为零后,在甲中加入FeCl2固体,乙中石墨电极为正极
D.盐桥中装有含琼胶的氯化钾饱和溶液,其作用是传递电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电解池(MEC)制氢工作原理如右图所示。用该电解池电解0.1mol·L-1的CH3COOH溶液,下列说法正确的是
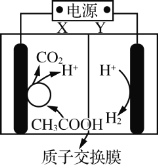
A.Y为电源的正极
B.该电解装置中,阳极的电极反应式为:CH3COOH+2H2O+8e-= 2CO2↑+8H+
C.当2mol H+通过质子交换膜时,则标准状况下产生22.4L H2
D.电解一段时间后,溶液中![]() 的值变小
的值变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com