
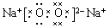
分析 A、B、C、D、E、F、G是原子序数依次增大的短周期元素,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,最高价氧化物对应水化物只有氢氧化铝能与酸、碱反应,故其中一种为氢氧化铝,另外为强酸与强碱,短周期内,强碱为氢氧化钠,原子序数E、F、G是原子序数依次增大,故E为钠元素,F为铝元素,G为硫元素或氯元素;A与B、C、D可分别形成10电子分子,且A与E同主族,则A为氢元素;D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,则D、G的原子序数中为2(1+11)=24,故D为氧元素,G为硫元素;B、C、D原子序数依次增大,都能与氢元素形成10电子分子,则B为碳元素,C为氮元素,据此进行解答.
解答 解:A、B、C、D、E、F、G是原子序数依次增大的短周期元素,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,最高价氧化物对应水化物只有氢氧化铝能与酸、碱反应,故其中一种为氢氧化铝,另外为强酸与强碱,短周期内,强碱为氢氧化钠,原子序数E、F、G是原子序数依次增大,故E为钠元素,F为铝元素,G为硫元素或氯元素;A与B、C、D可分别形成10电子分子,且A与E同主族,则A为氢元素;D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,则D、G的原子序数中为2(1+11)=24,故D为氧元素,G为硫元素;B、C、D原子序数依次增大,都能与氢元素形成10电子分子,则B为碳元素,C为氮元素,
故A为氢元素;B为碳元素,C为氮元素,D为氧元素,E为钠元素,F为铝元素,G为硫元素;
(1)由上述分析可知,E为钠;G为硫;F为铝元素,原子核外有9个电子,有2个电子层,最外层电子数为7,处于周期表中第三周期第ⅢA族,
故答案为:钠;硫;第三周期第ⅢA族;
(2)发生反应为:Zn+CuSO4═ZnSO4+Cu,形成铜锌-硫酸原电池,大大增加了反应速率,
故答案为:发生Zn+Cu SO4=ZnSO4+Cu↓,形成铜锌原电池,反应速率加快;
(3)D为氧元素,E为钠元素,钠在氧气中燃烧,生成过氧化钠,过氧化钠中阴阳离子个数比为1:2;过氧化钠为离子化合物,其电子式为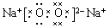 ,
,
故答案为:1:2;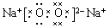 ;
;
(4)①都表示正反应速率,反应自始至终都按该比例进行,不能说明到达平衡,故①错误;
②恒温恒压下,随反应进行混合气体的相对分子质量增大,密度不变,说明混合气体的平均相对分子质量不变,说明反应到达平衡,故②正确;
③反应到达平衡NO2与N2O4浓度之比可能为2:1,可能不是2:1,与开始的浓度及转化率有关,不能说明到达平衡,故③错误;
④、二氧化氮是红棕色,四氧化二氮无色,混合气体的颜色不变,说明二氧化氮的浓度不变,说明反应到达平衡,故④正确;
⑤单位时间消耗4mol NO2的同时消耗2mol N2O4,消耗4mol NO2,生成2molN2O4,消耗与生成的N2O4的物质的量相等,说明反应到达平衡,故⑤正确.
故答案为:②④⑤;
(5)含0.5molNaOH的水溶液中通入标况下CO2气体11.2L,二氧化碳的物质的量为0.5mol,n(CO2):n(NaOH)=1:1,所以反应只生成碳酸氢钠,其化学反应方程式为:NaOH+CO2=NaHCO3,
故答案为:NaOH+CO2=NaHCO3.
点评 本题考查位置、结构与性质关系的应用,题目难度不大,涉及元素推断、电子式等化学用语、原电池、化学平衡、化学计算等,难度中等,推断元素指关键,突破口为E、F、G元素最高价氧化物对应水化物之间可相互发生反应及A与B、C、D可分别形成10电子分子.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
 ,它在一定条件下可能发生的反应是( )
,它在一定条件下可能发生的反应是( )| A. | ①③④⑤⑥⑦ | B. | ②③④⑤⑥ | C. | ①③⑤⑥⑦ | D. | ①③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| B. | 纤维素→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| C. | 油脂→甘油和高级脂肪酸→CO2和H2O(释放能量维持生命活动) | |
| D. | 麦芽糖→葡萄糖→CO2和H2O(释放能量维持生命活动) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
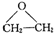 ,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$
,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$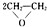 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z |  |
| A | 含氧酸 | 一元强酸 | HclO4 | |
| B | 易溶碱 | 强碱 | NaOH | |
| C | 盐 | 酸式盐 | NaHCO3 | |
| D | 非电解质 | 氧化物 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种元素组成的物质肯定是纯净物 | |
| B. | 一种元素可形成多种离子 | |
| C. | 含有金属元素的离子一定都是阳离子 | |
| D. | 具有相同质子数的粒子都属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9mol/L | B. | 0.18mol/L | C. | 0.42mol/L | D. | 0.84mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com