
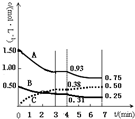
 有A、B、C三种气体在一个固定容积的容器中发生反应,体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )
有A、B、C三种气体在一个固定容积的容器中发生反应,体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )| A. | 该反应的化学方程式为3A(g)+B(g)═2C(g) | |
| B. | 若将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 | |
| C. | 若第4 min 时降低温度,到7 min时达到了新的平衡,则此反应的△H<0 | |
| D. | 反应在前3 min的平均反应速率υ(A)=0.31mol•L-1•min-1 |
分析 A.在反应中反应物的物质的量浓度减小,生成的物质的量浓度增加,根据图中的数据可知,A、B在反应中减小,C在反应中增加,所以A、B是反应物质,C是生成物,反应中△c(A)=1.50mol/L-0.93mol/L=0.57mol/L,△c(B)=0.50mol/L-0.31mol/L=0.19mol/L,△c(C)=0.50mol/L-0.31mol/L=0.38mol/L,各物质的物质的量的变化量之比等于计量数之比,所以反应方程式为3A(g)+B(g)═2C(g),据此判断;
B.若将初始投放的物质浓度增至原来的2倍,相当于加压,平衡向体积减小的方向移动,平衡常数只受温度的影响,据此判断;
C.根据图可知,第4min到第7minA、B的物质浓度减小,结合反应3A(g)+B(g)═2C(g),可知平衡向正反应方向移动,降低温度平衡向放热反应的方向移动,据此判断;
D.根据$v=\frac{△c}{t}$计算反应速率.
解答 解:A.在反应中反应物的物质的量浓度减小,生成的物质的量浓度增加,根据图中的数据可知,A、B在反应中减小,C在反应中增加,所以A、B是反应物质,C是生成物,反应中△c(A)=1.50mol/L-0.93mol/L=0.57mol/L,△c(B)=0.50mol/L-0.31mol/L=0.19mol/L,△c(C)=0.50mol/L-0.31mol/L=0.38mol/L,各物质的物质的量的变化量之比等于计量数之比,所以反应方程式为3A(g)+B(g)═2C(g),故A正确;
B.若将初始投放的物质浓度增至原来的2倍,相当于加压,结合反应3A(g)+B(g)═2C(g),平衡向正反应方向移动,反应物的转化率增大,平衡常数只受温度的影响,故B正确;
C.根据图可知,第4min到第7minA、B的物质浓度减小,结合反应3A(g)+B(g)═2C(g),可知平衡向正反应方向移动,降低温度平衡向放热反应的方向移动,所以正反应为放热反应,故C正确;
D.根据$v=\frac{△c}{t}$可知A的反应速率为$\frac{1.50mol/L-0.93mol/L}{3min}$=0.19mol/(L•min),故D错误,
故选D.
点评 题为化学平衡图象题.解化学平衡图象题,看图象:一看轴,弄清横坐标和纵坐标的意义.二看点,弄清图象上点的意义,看起点,交点,转折点,终点.三看量的变化,利用相关公式进行计算,明确外界条件对化学平衡的影响是解本题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 则原混合物中E、G的物质的量之比为1:1.
则原混合物中E、G的物质的量之比为1:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用托盘天平称取10.20g氢氧化钠 | |
| B. | 某实验需要900mL的0.1mol/L的硫酸铜溶液,则配得该溶液需称取22.5g胆矾晶体 | |
| C. | 用10mL量筒量取5.2mL硫酸,仰视时实际量得液体提及大于5.2mL | |
| D. | 焰色反应实验中,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
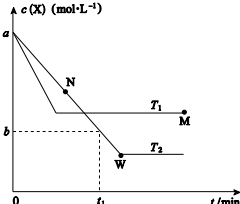 在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )
在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )| A. | 该反应进行到M 点放出的热量大于进行到W 点放出的热量 | |
| B. | T2 下,在0~t1 时间内,v(Y)═$\frac{a-b}{{t}_{1}}$mol•L-1•min-1 | |
| C. | M 点的平衡常数小于W 点的平衡常数 | |
| D. | M 点时再加入一定量X,平衡后X 的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol 对苯二甲酸中含有双键的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 固体2是氧化铁 | |
| B. | X的化学式可以表示为Fe3C2 | |
| C. | 溶液甲加热、蒸发、灼烧也可得到24.0g固体 | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收少量二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | 过量的铁粉与浓硝酸反应:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O | |
| D. | 向漂白粉溶液中通入适量SO2:Ca2++2C1O-+SO2+H2O═CaSO3↓+2HC1O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (NH3)=0.2 mol/(L•s) | B. | v (O2)=1.4mol/(L•min) | ||
| C. | v (H2O)=0.25 mol/(L•s) | D. | v (NO)=9 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com