
科目:高中化学 来源: 题型:解答题
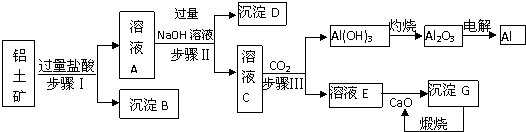
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
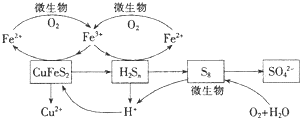
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 干冰和氯化铵变成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g乙酸与足量乙醇发生酯化反应.充分反应后断裂的C-O键数目为NA | |
| B. | 室温下向1LpH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| D. | 己知C2H4(g)+H2(g)=C2H4(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种阳离子和一种阴离子 | B. | 一种单质分子和一种化合物分子 | ||
| C. | 两种原子 | D. | 一种原子和一种分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
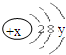 试回答:
试回答: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com